题目内容
15.常温下,下列有关电解质溶液的说法正确的是( )| A. | 用少量水稀释0.1mol•L-1氨水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 将Na2CO3溶液从20℃升温至30℃,溶液中增大$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}$增大 | |
| C. | 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3•H2O) | |
| D. | pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-) |
分析 A.用水稀释0.1mol/L氨水时,加水稀释,促进氨水电离,n(OH-)增大,n(NH3.H2O)减少;
B.根据将Na2CO3溶液从20℃升温至30℃,水解程度增大即反应物离子变少,生成物离子增多判断;
C.根据电荷守恒结合NH4Cl溶液中的物料守恒判断;
D.根据pH=5.5的CH3COOH与CH3COONa混合溶液中电荷守恒判断.
解答 解:A.加水稀释,促进氨水电离,n(OH-)增大,n(NH3.H2O)减少,所以$\frac{\frac{n(OH{\;}^{-})}{V}}{\frac{n(NH{\;}_{3}.H{\;}_{2}O)}{V}}$增大,即$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大,故A错误;
B.Na2CO3溶液从20℃升温至30℃,水解程度增大,所以碳酸根离子的物质的量减小,水解生成的碳酸氢根和氢氧根物质的量都增大,又在同一溶液中,体积相等,所以$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}$减小,故B错误;
C.向NH4Cl溶液中加入NaOH溶液至呈中性,根据电荷守恒,则有c(NH4+)+c(Na+)=c(Cl-),又NH4Cl溶液中物料守恒,(Cl-)=c(NH4+)+c(NH3•H2O),所以c(Na+)=c(NH3•H2O),故C正确;
D.pH=5.5的CH3COOH与CH3COONa混合溶液中,根据电荷守恒,则有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又pH=5.5,c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),故D错误;
故选C.
点评 本题对弱电解质的电离及其盐类的水解与离子浓度大小比较、酸碱混合溶液定性判断联合考查,结合物料守恒和电荷守恒解答即可,难度中等.

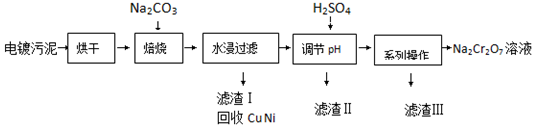
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |

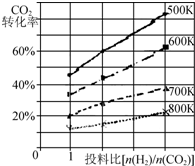 将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H
将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);△H