题目内容
2.反应NO+O2+NO2+H2O→HNO3是多组化学计量数的化学方程式,当氧气有$\frac{1}{3}$被NO还原时,此方程式中各物质的化学计量数依次为( )| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
分析 O2有$\frac{1}{3}$被NO还原,则有$\frac{2}{3}$被NO2还原,根据得失电子守恒,确定NO、NO2+的物质的量,利用N原子、H原子守恒确定H2O、HNO3的物质的量,以此来解答.
解答 解:O2有$\frac{1}{3}$被NO还原,则有$\frac{2}{3}$被NO2还原,根据得失电子守恒,n(O2)×2×$\frac{1}{3}$×(2-0)=n(NO)×(5-2),即n(NO):n(O2)=4:9,
n(O2)×2×$\frac{2}{3}$×(2-0)=n(NO2)×(5-4),即n(NO2):n(O2)=8:3,
设氧气的物质的量为x,即n(NO)=$\frac{4}{9}$x,n(NO2)=$\frac{8}{3}$x,
由N原子守恒,可知生成HNO3 $\frac{28x}{3}$mol,
由H原子守恒,可知H2O为$\frac{14}{9}$xmol,
所以NO、O2、NO2、H2O、HNO3的物质的量之比=$\frac{4}{9}$x:x:$\frac{8}{3}$x:$\frac{28x}{3}$mol=4:9:24:14:28,该反应方程式为:4NO+9O2+24NO2+14H2O═28HNO3,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握氧化还原反应中电子守恒及原子守恒为解答的关键,侧重分析能力及计算能力的考查,题目难度不大.

练习册系列答案
相关题目
11.KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是( )
| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
8.等体积、等浓度的下列溶液,含Cl-最少的溶液是( )
| A. | CaCl2 | B. | KCl | C. | AlCl3 | D. | SnCl4 |
15.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 用少量水稀释0.1mol•L-1氨水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 将Na2CO3溶液从20℃升温至30℃,溶液中增大$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}$增大 | |
| C. | 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3•H2O) | |
| D. | pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-) |
11.某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
( 1)加入碎瓷片的作用是防止瀑沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是催化剂、吸水剂混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
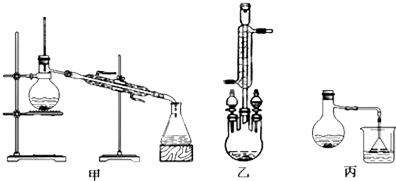
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点最好采用装置乙(填“甲”或“乙”或“丙”).
Ⅱ.粗产品的精制
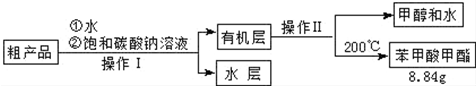
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅱ分液;蒸馏.
(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(6)列式计算,苯甲酸甲酯的产率是65%.
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g•mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品.
( 1)加入碎瓷片的作用是防止瀑沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是催化剂、吸水剂混合液体时最后加入浓硫酸的理由:浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发.
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去).根据有机物的沸点最好采用装置乙(填“甲”或“乙”或“丙”).

Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称.操作Ⅱ分液;蒸馏.

(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是氢氧化钠是强碱,促进苯甲酸甲酯的水解,导致产品损失.
(6)列式计算,苯甲酸甲酯的产率是65%.
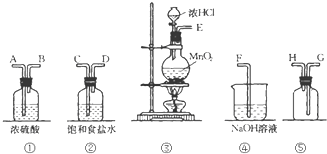 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.