题目内容
3.电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过下述流程回收Na2Cr2O7等物质.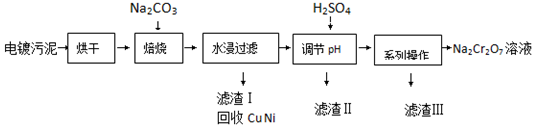
已知:
①Cr(OH)3、ZnO和Al2O3一样均为两性化合物;
②Na2Cr2O7、Na2SO4在不同温度下的溶解度如表:
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
(2)加入H2SO4调节pH的目的为除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)得到滤渣Ⅲ的“系列操作”的步骤为蒸发浓缩、冷却结晶 过滤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g,CrO42-有8/9转化为Cr2O72-,求转化后所得溶液中c(Cr2O72-)=0.2mol•L-1;
(5)向Na2Cr2O7与H2SO4混合液中加入H2O2,再加入乙醚并摇动,乙醚层为蓝色.乙醚中溶有CrO5,则发生反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.
分析 以含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质的电镀污泥为原料,烘干后加入碳酸钠和氧气高温灼烧发生反应4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2,Al2O3+Na2CO3$\frac{\underline{\;高温\;}}{\;}$2NaAlO2+CO2↑,ZnO+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2ZnO2+CO2↑,水浸后过滤得到滤渣CuO、NiO,滤液为Na2CrO4,NaAlO2、Na2ZnO2等,调节溶液PH沉淀ZnO22-离子和偏铝酸根离子,过滤得到滤液Na2CrO4,滤渣Ⅱ的主要成分有Zn(OH)2、Al(OH)3,滤液Na2CrO4加入硫酸酸化生成重铬酸钠溶液,通过提纯得到重铬酸钠,
(1)根据上面的分析可知,氢氧化铬与碳酸钠在氧气的作用下被氧化成铬酸钠;焙烧后的固体中Na2CrO4、Na2ZnO2、NaAlO2都溶于水;
(2)水浸后溶液中存在Na2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,从平衡移动的角度分析,同时NaAlO2、Na2ZnO2杂质与酸反应;
(3)铬酸钠中加入硫酸生成重铬酸钠和硫酸钠,所以得到滤渣Ⅲ应为硫酸钠,根据两种物质的溶解度与温度的关系可确定操作步骤;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g即铬的物质的量为$\frac{23.4g}{52g/mol}$=0.45mol,根据铬元素守恒可计算出所得溶液中c(Cr2O72-);
(5)Na2Cr2O7与H2O2,在酸性条件下反应生成CrO5,根据元素守恒书写反应的化学方程式.
解答 解:(1)根据上面的分析可知,氢氧化铬与碳酸钠在氧气的作用下被氧化成铬酸钠,反应的化学方程式为4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2,焙烧后的固体中Na2CrO4、Na2ZnO2、NaAlO2都溶于水,所以水浸后溶液中的溶质除Na2CrO4还存在 NaAlO2、Na2ZnO2,
故答案为:4Cr(OH)3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+6H2O+4CO2; NaAlO2、Na2ZnO2;
(2)水浸后溶液中存在Na2CrO4,加入硫酸发生CrO42-+2H+?Cr2O72-+H2O,NaAlO2、Na2ZnO2与酸反应,可以除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-,
故答案为:除去溶液中NaAlO2、Na2ZnO2杂质,并将CrO42-转化为Cr2O72-;
(3)铬酸钠中加入硫酸生成重铬酸钠和硫酸钠,所以得到滤渣Ⅲ应为硫酸钠,根据两种物质的溶解度与温度的关系可知重铬酸钠的溶解度较大,而硫酸钠的溶解度较小,所以得到滤渣Ⅲ硫酸钠的步骤为 蒸发浓缩、冷却结晶、过滤,
故答案为:蒸发浓缩;冷却结晶;
(4)若1L加入H2SO4后所得溶液中含铬元素质量为23.4g即铬的物质的量为$\frac{23.4g}{52g/mol}$=0.45mol,CrO42-有8/9转化为Cr2O72-,所以溶液中n(Cr2O72-)=0.45mol×$\frac{8}{9}$=×$\frac{1}{2}$0.2 mol,则溶液中c(Cr2O72-)=0.2mol•L-1,
故答案为:0.2;
(5)Na2Cr2O7与H2O2,在酸性条件下反应生成CrO5,反应的化学方程式为Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O,
故答案为:Na2Cr2O7+4H2O2+H2SO4═2CrO5+Na2SO4+5H2O.
点评 本题考查了物质的分离提纯流程,主要考查了操作流程分析、平衡状态的判断、溶度积常数的计算、方程式的书写等,题目难度中等,侧重于考查学生分析问题、解决问题能力和计算能力.

| A. | 利用溶于水后“过滤”操作能分离NaCl和Ba(OH)2 | |
| B. | 实验结束后,用嘴吹灭酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 |
| A. | 3 mol H2S可还原4mol的KIO3 | |
| B. | 氧化剂和还原剂物质的量之比为5:4 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
| A. | 3.2g S在反应中转移电子数为0.2NA | |
| B. | 0.1mol Fe在反应中转移电子数为0.3NA | |
| C. | 6.5g Zn在反应中转移电子数为0.2NA | |
| D. | 11.2L O2在反应中转移电子数为0.2NA |
| A. | CaCl2 | B. | KCl | C. | AlCl3 | D. | SnCl4 |
| A. | 用少量水稀释0.1mol•L-1氨水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 将Na2CO3溶液从20℃升温至30℃,溶液中增大$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}$增大 | |
| C. | 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3•H2O) | |
| D. | pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-) |
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
 影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.
影响化学反应速率的因素很多,某同学设计了以下实验研究不同浓度的硫酸对反应速率的影响.