题目内容
7.当电解质溶液为氢氧化钾水溶液的甲烷燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )| A. | 当电池正极消耗mg气体时,电解池阴极同时有mg气体生成 | |
| B. | 电解后c(Na+)与c(CO32-)的比值变小 | |
| C. | 电池中c(KOH)不变;电解池中溶液pH变大 | |
| D. | 电解后c(Na2CO3)不变 |
分析 该燃料电池为碱性电池,电池的正极反应为:O2+2H20+4e-═4OH-,负极反应为CH4+10OH--8e-=CO32-+7H2O,电解饱和碳酸钠溶液阴极发生的反应为:2H++2e-═H2↑,阳极反应为:4OH--4e-═O2↑+2H20,以此结合电子守恒计算解答.
解答 解:A.原电池的正极反应为O2+2H20+4e-═4OH-,当转正极消耗mg气体时,转移的电子的物质的量为$\frac{m}{32}$mol×2=$\frac{m}{16}$mol,电解池阴极得电子为 $\frac{m}{16}$mol,阴极发生的反应为:2H++2e-═H2↑,阴极生成气体的质量为 $\frac{m}{16}$mol×2g/mol=$\frac{m}{8}$g,故A错误;
B.电解后,由于电解了水,水的质量减小,碳酸钠为饱和溶液,所以会析出碳酸钠晶体,但是c(Na2CO3)不变,所以c(Na+)与c(CO32-)的比值不变,故B错误;
C.甲烷燃料电池的总反应为:CH4+2O2+2OH-=CO32-+3H2O,反应消耗氢氧化钾,则c(KOH)减小,pH减小,故C错误;
D.电解后,由于电解了水,水的质量减小,碳酸钠为饱和溶液,所以会析出碳酸钠晶体,但是c(Na2CO3)不变,故D正确;
故选:D.
点评 本题考查了燃料电池和电解池原理的应用,注意把握溶液的酸碱性与电极反应的关系以及电子守恒在计算中的应用,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
15.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 用少量水稀释0.1mol•L-1氨水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小 | |
| B. | 将Na2CO3溶液从20℃升温至30℃,溶液中增大$\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}$增大 | |
| C. | 向NH4Cl溶液中加入NaOH溶液至呈中性,溶液中c(Na+)=c(NH3•H2O) | |
| D. | pH=5.5的CH3COOH与CH3COONa混合溶液中c(Na+)>c(CH3COO-) |
18.实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示: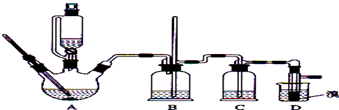
有关数据列表:
回答下列问题:
(1)写出实验室制乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)在此实验中,装置A要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下面的选择题相同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在此实验中,装置A中要加些沸石,原因是防止液体暴沸;
(4)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:
a.水 b.浓硫酸 c.氢氧化钠溶液 d.CCl4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.应用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发.

有关数据列表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)写出实验室制乙烯的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
(2)在此实验中,装置A要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母,下面的选择题相同)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在此实验中,装置A中要加些沸石,原因是防止液体暴沸;
(4)在装置C中应加入C,其目的是吸收反应中可能生成的酸性气体:
a.水 b.浓硫酸 c.氢氧化钠溶液 d.CCl4
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(6)若产物中有少量副产物乙醚.应用蒸馏的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发.
15.在容积固定的密闭容器中充入一定量的X、Y两种气体,一定条件下发生可逆反应:3X(g)+Y(g)?2Z(g),并达到平衡.已知正反应是放热反应,测得X的转化率为37.5%,Y的转化率为25%,下列有关叙述正确的是( )
| A. | 若X的反应速率为0.2 mol/(L•s),则Z的反应速率为0.3 mol/(L•s) | |
| B. | 若向容器中充入氦气,压强增大,Y的转化率提高 | |
| C. | 升高温度,正反应速率减小,平衡向逆反应方向移动 | |
| D. | 开始充入容器中的X、Y物质的量之比为2:1 |
2.反应A(g)?2B(?)+C(g)-Q已达到平衡,假设A、C状态始终保持不变,下列说法正确的是( )
| A. | 当混合气体的质量不变,说明反应已达到平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体平均相对分子质量不变或增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度可能增大 |
19.已知NO2为红棕色气体,而N2O4为无色气体,某温度下,反应N2O4(g)?2NO2(g);△H>0.在密闭容器中达到平衡,下列说法正确的是( )
| A. | 缩小容器体积,NO2体积分数减小,混合气体颜色变浅 | |
| B. | 保持容器体积不变,加入少许NO2,重新达到平衡时,NO2的体积分数增大 | |
| C. | 保持容器体积不变,加入少许N2O4再达到平衡时,气体颜色变深 | |
| D. | 保持容器体积不变,加入少许NO2,将使正反应速率减小 |
16.对于以下反应:A(s)+3B(g)?2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是( )
| A. | 混合气体的密度不随时间变化而变化 | |
| B. | 3v正(B)=v逆(D) | |
| C. | D的物质的量分数在混合气体中保持不变 | |
| D. | B、C、D的分子个数之比为3:2:1 |