题目内容
3.某同学设计原电池装置如图所示,下列说法正确的是( )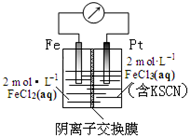
| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e?=Fe | |
| D. | 若转移1mol e-,交换膜左侧溶液中则减少1 molCl- |
分析 A.电子由负极流向正极;
B.右侧中铁离子得电子生成亚铁离子;
C.正极上铁离子得电子生成亚铁离子;
D.转移1mole-,则右侧中有1molCl-进入左侧.
解答 解:A.Fe为负极,Pt为正极,电子由负极流向正极,即电子由铁极经导线向铂极迁移,电子不能通过溶液,故A错误;
B.右侧中铁离子得电子生成亚铁离子,电极反应为Fe3++e-=Fe2+,溶液颜色变浅,故B正确;
C.正极上铁离子得电子生成亚铁离子,则正极的电极反应式为Fe3++e-=Fe2+,故C错误;
D.转移1mol电子时,正极附近电解质溶液中大约有1molCl-透过阴离子交换膜向铁极附近迁移(交换膜左侧溶液),Fe3+变Fe2+,阳离子数目没有改变,交换膜右侧溶液中离子约减少1molCl-,故D错误.
故选B.
点评 本题考查原电池知识,侧重于原电池的原理的应用的考查,注意把握电解方程式的书写以及原电池的工作原理,难度不大.

练习册系列答案
相关题目
11.羟氨苄青霉素是高效、广谱和低毒的抗生素,其结构简式如图所示.下列说法错误的是( )

| A. | 羟氨苄青霉素在空气中不能很稳定地存在 | |
| B. | 每个羟氨苄青霉素分子中含有3个手性碳原子 | |
| C. | 羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 | |
| D. | 羟氨苄青霉素可以与FeCl3发生显色反应 |
18.下列有关金属及其化合物的说法正确的是( )
| A. | 铝和氢氧化钠溶液反应生成Al(OH)3和Na | |
| B. | 钠在空气中燃烧生成淡黄色的NaO2 | |
| C. | 铁在高温下与水蒸气反应生成Fe3O4和H2 | |
| D. | 用碳酸钠和氢氧化钙反应制NaHCO3 |
8.下列有关物质分类或归纳不正确的是( )
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
15.CaO+H2O=Ca(OH)2的反应类型属于( )
| A. | 化合反应 | B. | 分解反应 | C. | 置换反应 | D. | 复分解反应 |
6.如表实验操作正确的是( )
| 实验 | 操作 | |
| A | 观察钠与水反应的现象 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 检验NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水 |
| C | 证明Na2O2与CO2是放热反应 | Na2O2用棉花包裹,放入充满CO2的集气瓶中,棉花燃烧说明是放热反应 |
| D | 检验Na2CO3与K2CO3溶液 | 用稀硫酸清洗过的铂丝分别蘸取溶液,在酒精灯外焰上灼烧,透过蓝色钴玻璃观察火焰的颜色 |
| A. | A | B. | B | C. | C | D. | D |
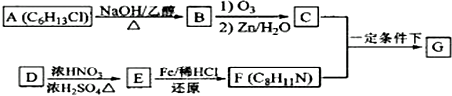


 +HO-NO2$→_{△}^{浓H_{2}SO_{4}}$
+HO-NO2$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. .
. (写出其中一种的结构简式).
(写出其中一种的结构简式).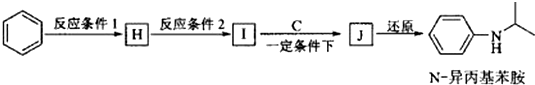
 .
.