题目内容
11.羟氨苄青霉素是高效、广谱和低毒的抗生素,其结构简式如图所示.下列说法错误的是( )
| A. | 羟氨苄青霉素在空气中不能很稳定地存在 | |
| B. | 每个羟氨苄青霉素分子中含有3个手性碳原子 | |
| C. | 羟氨苄青霉素既能与盐酸反应,又能与碳酸氢钠溶液反应 | |
| D. | 羟氨苄青霉素可以与FeCl3发生显色反应 |
分析 由结构可知,分子中含酚-OH、-CONH-、-COOH、氨基等,结合酚、羧酸等有机物的性质来解答.
解答 解:A.含酚-OH,易被氧化,不能稳定存在,故A正确;
B.连接4个不同基团的C为手性C,则 中标黑点的4个C为手性碳原子,故B错误;
中标黑点的4个C为手性碳原子,故B错误;
C.含-COOH,与碳酸氢钠反应,含氨基与盐酸反应,故C正确;
D.含酚-OH,可以与FeCl3发生显色反应,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质,题目难度不大.

练习册系列答案
相关题目
2.已知空气-锌电池的电极反应为:锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:$\frac{1}{2}$O2+H2O+2e-=2OH-,下列关于该电池的说法不正确的是( )
| A. | Zn为电池的负极,被氧化 | B. | O2为负极,被还原 | ||
| C. | 该电池的总反应是2Zn+O2=2ZnO | D. | 该电池是将化学能转化为电能 |
19.一定条件下,可逆反应2SO2(g)+O2(g)?2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是( )
| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
6.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜 | |
| B. | 标准标况下,33.6 L三氧化硫中含有1.5NA个三氧化硫分子 | |
| C. | 1 mol Cl2与过量的铁反应,转移3NA个电子 | |
| D. | 1 mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
16.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是( )
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
3.某同学设计原电池装置如图所示,下列说法正确的是( )
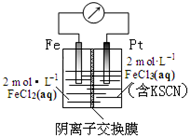

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e?=Fe | |
| D. | 若转移1mol e-,交换膜左侧溶液中则减少1 molCl- |
20.亚硝酸盐参加反应时,既可作氧化剂,也可作还原剂,当它作氧化剂时,可能的产物是( )
| A. | NH4 | B. | N2 | C. | N2O5 | D. | N2O3 |
14.一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,以此二甲醚燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )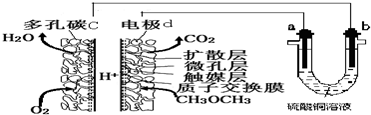

| A. | 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O═2CO2+12H+ | |
| C. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇CH3OH)直接燃料电池能量密度的1.4倍 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
 已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断:
已知甲、乙、丙是初中化学常见的三种物质,它们的组成元素中只有一种相同,其中乙物质能参与绿色植物的光合作用.转化关系如图所示,试判断: