题目内容
8.下列有关物质分类或归纳不正确的是( )①电解质:明矾、冰醋酸、氯化银、纯碱
②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银
④同素异形体:金刚石、石墨、C60.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 ①电解质是水溶液中或熔融状态下导电的化合物;
②化合物是不同盐酸组成的纯净物;
③混合物是由不同种物质组成的物质;
④同素异形体是相同元素组成的不同单质.
解答 解:①电解质是水溶液中或熔融状态下导电的化合物,明矾属于盐、冰醋酸属于酸、氯化银属于盐、纯碱是盐,符合电解质的概念,都是电解质,故①正确;
②化合物是不同盐酸组成的纯净物,BaCl2、Ca(OH)2、HNO3都是化合物,HT是氢气的单质,故②错误;
③因混合物是由不同种物质组成的物质,盐酸是氯化氢气体的水溶液、漂白粉是氯化钙和次氯酸钙的混合物、水玻璃是硅酸钠的水溶液、水银是金属单质不是混合物,故③错误;
④同素异形体是相同元素组成的不同单质,金刚石、石墨、C60符合同素异形体的概念,故④正确;
故选B.
点评 本题考查了化学概念的分析判断,物质组成的掌握和分类原则的理解是解题关键,题目较简单.

练习册系列答案
相关题目
19.一定条件下,可逆反应2SO2(g)+O2(g)?2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是( )
| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
16.下列各元素的氧化物中,既能与盐酸反应,又能够与NaOH溶液反应生成盐和水的是( )
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
3.某同学设计原电池装置如图所示,下列说法正确的是( )
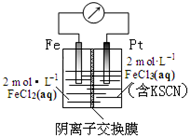

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e?=Fe | |
| D. | 若转移1mol e-,交换膜左侧溶液中则减少1 molCl- |
13.将等物质的量的Na、Na2O、Na2O2、NaOH放入等质量的足量水中制成NaOH溶液,编号依次是甲、乙、丙、丁,所得的溶液中溶质的质量分数的说法正确的是( )
| A. | 甲=乙=丙=丁 | B. | 乙=丙>甲=丁 | C. | 乙>丙>甲>丁 | D. | 乙=丙>甲>丁 |
20.亚硝酸盐参加反应时,既可作氧化剂,也可作还原剂,当它作氧化剂时,可能的产物是( )
| A. | NH4 | B. | N2 | C. | N2O5 | D. | N2O3 |
10.下列物质中,既含有共价键又含有离子键的是( )
| A. | HF | B. | NaCl | C. | HCl | D. | KOH |


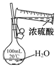
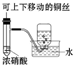
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.