题目内容
1.某化学反应2A?B+D在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表:| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 050 |
| 2 | 800℃ | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.60 |
(1)在实验1,反应在10至20分钟时间内平均速率为0.013mol/(L•min).
(2)在实验2,A的初始浓度c2=1.0mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是催化剂.
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3>v1(填>、=、<),且c3=>1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应吸热(选填吸热、放热).理由是由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
分析 (1)根据v=$\frac{△c}{△t}$解题;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验2使用了催化剂,加快了反应速率,缩短了达平衡的时间;
(3)以10至20min为例求出实验1和实验3的反应速率进行比较;
(4)根据化学平衡移动原理分析,加热平衡向吸热反应方向移动.
解答 解:(1)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
故答案为:0.013;
(2)实验1和实验2达到平衡时A的浓度不再改变且相等,说明实验2与实验1其他条件完全相同,实验1与实验2中A的初始浓度应相等,起始浓度c2=1.0mol/L,实验2较其他实验达到平衡时间最短,是使用了合适的催化剂,
故答案为:1.0;催化剂;
(3)在实验1中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.80mol/L-0.67mol/L}{10min}$=0.013mol•(L•min)-1,
在实验3中,反应在10至20min时间内平均速率为v=$\frac{△c}{△t}$=$\frac{0.92mol/L-0.75mol/L}{10min}$=0.015mol•(L•min)-1,故v3>v1,实验1的其实浓度为1.0mol/L,由平衡时浓度可知在实验3的起始浓度大于1.0mol/L,
故答案为:>;>;
(4)比较实验4和实验1可知平衡时实验4反应物A的浓度小,由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动;
故答案为:吸热;由实验1到实验4升高温度,平衡右移,加热平衡向吸热反应方向移动.
点评 本题考查反应速率的表示方法,化学平衡移动的判断,掌握反应速率的计算方法是解题的关键,题目难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | 23gNa一定条件下与足量的O2反应转移的电子数一定为NA | |
| B. | 标准状态下,2.24LCCl4中的分子数目为0.1NA | |
| C. | 1L1 mol/L饱和FeCl3溶液滴入沸水中完全水解生成NA个氢氧化铁胶体粒子 | |
| D. | 0.1 mol•L-1 氢氧化钠溶液中所含钠离子数为0.1NA |
| A. | 硝基苯的结构简式: | B. | CO2分子比例模型: | ||
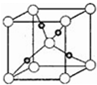
| C. | NH4Cl的电子式: | D. | NaCl的晶体模型: |
| A. | 金刚石、碳化硅、晶体硅的熔点依次升高 | |
| B. | CO2和SiO2 化学式相似,物理性质也相似 | |
| C. | CH3CH(CH2OH)CH2OOCCH3是一种手性分子,水解后手性消失 | |
| D. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 |

 .
. ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.

 .
. 、
、 、
、 (其中三种).
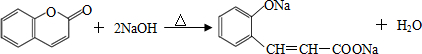
(其中三种). 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.