题目内容
5.现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图1所示.已知
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3-+I2=2IO3-+Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为1:6,还原产物是KBr.
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式BrO3-+5Br-+6H+=3Br2+3H2O.
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由不正确;该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论.
(4)含6mol KI的硫酸溶液所能消耗n(KBrO3)的最大值为7.2.
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图2所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.阳极的电极反应式为I-+6OH--6e-=IO3-+3H2O;阴极观察到的现象是有气泡产生.
分析 (1)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,结合氧化剂、还原剂得失电子数目相等判断还原产物;
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应;
(3)根据反应2BrO3-+I2═2IO3-+Br2,氧化剂的氧化性强于氧化产物的氧化性来回答;
(4)根据关系式KI~I2~IO3-以及bc段反应BrO3-~Br-,写出反应的总方程式进行计算;
(5)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,阴极上氢离子放电生成氢气.
解答 解:(1)b点时,KI反应完全,有图象可知参加反应的KI为6mol,KBrO3为1mol,则消耗的氧化剂与还原剂物质的量之比为1:6,
发生反应为6I-+BrO3-=Br-+3I2,还原产物是KBr,故答案为:1:6;KBr;
(2)b→c过程中,仅有一种元素发生化合价变化,应是BrO3-与Br-之间的氧化还原反应,反应的离子方程式为BrO3-+5Br-+6H+=3Br2+3H2O,
故答案为:BrO3-+5Br-+6H+=3Br2+3H2O;
(3)根据反应:2BrO3-+I2═2IO3-+Br2,还原剂的还原性强于还原产物的氧化性,所以得出还原性I2>Br2,故答案为:不正确;该反应中I2作还原剂,Br2为还原产物,应得出还原性I2>Br2结论;
(4)发生的反应依次有6I-+6H++BrO3-=Br-+3I2+3H2O,BrO3-+5Br-+6H+=3Br2+3H2O,2BrO3-+I2=2IO3-+Br2,
总反应为5I-+6H++6BrO3-=5IO3-+3Br2+3H2O,则含6molKI的硫酸溶液所能消耗n(KBrO3)的最大值为1.2×6mol=7.2mol,
故答案为:7.2;
(5)阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成IO3-,电极方程式为I-+6OH--6e-=IO3-+3H2O,阴极上氢离子放电生成氢气,所以阴极现象:有气泡产生,
故答案为:I-+6OH--6e-=IO3-+3H2O;有气泡产生.
点评 本题考查氧化还原反应,题目难度中等,本题注意根据关系的关系式计算,为解答该题的关键,也是易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氧化铁的化学式:FeO | |
| B. | 聚乙烯的结构简式为CH2=CH2 | |
| C. | 16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体 | |
| D. | 质子数为53,中子数为78的碘原子表示为:${\;}_{53}^{131}$I |
| A. | 硝基苯的结构简式: | B. | CO2分子比例模型: | ||
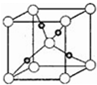
| C. | NH4Cl的电子式: | D. | NaCl的晶体模型: |
 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略) | 序号 | 条件 | 现象和结论 | |
| 温度/℃ | 催化剂 | ||
| 1 | 40 | FeCl3溶液 | |
| 2 | 20 | FeCl3溶液 | |
| 3 | 20 | MnO2 | |
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
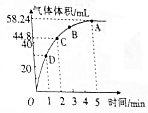
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
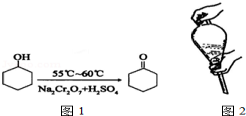 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环乙醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).
 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
 .
. 、
、 、
、 (其中三种).
(其中三种). 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
. 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.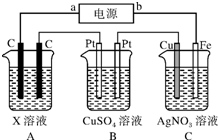 如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答: