题目内容
6.某有机物有下列转化关系:
请回答下列问题:
(1)反应①的反应条件是光照.
(2)属于取代反应的是(填反应序号)①②⑤.
(3)写出下列各步反应的化学方程式:
②
 ;
;③
 ;
;④
 ;
;⑤
 ;
;⑥
 ;
;⑧
 ;
;(4)有机物A有多种同分异构体,其中符合下列条件的同分异构体有5种.
①苯环上有两个对位取代基 ②能发生水解反应 ③能发生银镜反应.
分析 由流程图可知 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成 ,
, 发生消去反应生成
发生消去反应生成 ,
, 发生加聚反应生成
发生加聚反应生成 ,
, 发生水解反应生成
发生水解反应生成 ,
, 在酸性条件下被高锰酸钾氧化反应生成
在酸性条件下被高锰酸钾氧化反应生成 ,
, 催化氧化生成
催化氧化生成 ,
, 进一步氧化生成
进一步氧化生成 ,
, 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成 ,以此解答该题.
,以此解答该题.
解答 解:由流程图可知 在光照条件下发生取代反应生成
在光照条件下发生取代反应生成 ,
, 发生消去反应生成
发生消去反应生成 ,
, 发生加聚反应生成
发生加聚反应生成 ,
, 发生水解反应生成
发生水解反应生成 ,
, 在酸性条件下被高锰酸钾氧化反应生成
在酸性条件下被高锰酸钾氧化反应生成 ,
, 催化氧化生成
催化氧化生成 ,
, 进一步氧化生成
进一步氧化生成 ,
, 与乙醇发生酯化反应生成
与乙醇发生酯化反应生成 ,
,
(1)由以上分析可知反应①的反应条件是光照,取代烃基上的H,故答案为:光照;
(2)属于取代反应的为①②⑤,故答案为:①②⑤;
(3)②为 发生水解反应生成
发生水解反应生成 ,方程式为
,方程式为 ,
,
③为 催化氧化生成
催化氧化生成 ,方程式为
,方程式为 ,
,
④为 进一步氧化生成
进一步氧化生成 ,方程式为
,方程式为 ,
,
⑤为酯化反应,方程式为 ,
,
⑥为 在酸性条件下被高锰酸钾氧化反应生成
在酸性条件下被高锰酸钾氧化反应生成 ,方程式为
,方程式为 ,
,
⑧为 发生加聚反应生成
发生加聚反应生成 ,方程式为
,方程式为 ,
,
故答案为: ;
; ;
; ;
; ;
; ;
; ;
;
(4)A为 ,对应的同分异构体①苯环上有两个对位取代基 ②能发生水解反应,说明含有酯基,③能发生银镜反应,应为甲酸酯,可能的结构有HCOOCH2CH2-Φ-CH3、HCOOCH2-Φ-CH2CH3、HCOO-Φ-CH2CH2CH3、HCOO-Φ-CH(CH3)2、HCOOCH(CH3)-Φ-CH3,共5种(Φ为苯环),
,对应的同分异构体①苯环上有两个对位取代基 ②能发生水解反应,说明含有酯基,③能发生银镜反应,应为甲酸酯,可能的结构有HCOOCH2CH2-Φ-CH3、HCOOCH2-Φ-CH2CH3、HCOO-Φ-CH2CH2CH3、HCOO-Φ-CH(CH3)2、HCOOCH(CH3)-Φ-CH3,共5种(Φ为苯环),
故答案为:5.
点评 本题考查有机物的合成,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质以及转化关系,难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
17. 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
请回答下列问题:
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
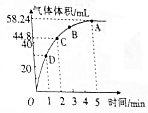
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
 取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)
取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略) | 序号 | 条件 | 现象和结论 | |
| 温度/℃ | 催化剂 | ||
| 1 | 40 | FeCl3溶液 | |
| 2 | 20 | FeCl3溶液 | |
| 3 | 20 | MnO2 | |
(1)实验1、2研究的是温度对H2O2分解速率的影响.
(2)实验2、3的目的是不同催化剂对过氧化氢分解速率的影响.
(3)加入0.1mol MnO2粉末于50mL过氧化氢溶液(密度为1.1g•mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示.
①A、B、C、D四点的化学反应速率快慢的顺序为D>C>B>A.
②过氧化氢的初始物质的量浓度为0.104 mol•L-1.
③反应进行到2min时过氧化氢的质量分数为0.074%.
14.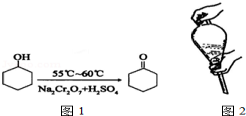 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯.其主要步骤有dbeca(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).
 环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:
环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如图1;环己醇和环己酮的部分物理性质见表:| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环乙醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是dbeca.
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,不正确的是ABC.
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图2用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中,采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是60%(保留两位有效数字).
1.下列说法正确的是( )
| A. | 分子中含有羟基的物质溶于水后,溶液一定显酸性 | |
| B. | 丙酸、乙酸甲酯、甲酸乙酯互为同分异构体 | |
| C. | 能发生银镜反应的一定是醛 | |
| D. | 乙醇发生酯化反应断裂碳氧键而失去羟基 |
11.下列说法中正确的是( )
| A. | 金刚石、碳化硅、晶体硅的熔点依次升高 | |
| B. | CO2和SiO2 化学式相似,物理性质也相似 | |
| C. | CH3CH(CH2OH)CH2OOCCH3是一种手性分子,水解后手性消失 | |
| D. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 |
 ④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为;1mol尿素分子中,σ 键的数目为7NA.

 .
. .
. .
.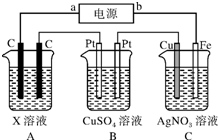 如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:
如图所示,电解一段时间后,测得C中Ag+减少了0.1mol,Fe电极被溶解.试回答:

 ,1中官能团的名称酯基和羰基.
,1中官能团的名称酯基和羰基. .
. 写出合成路线图.
写出合成路线图.