题目内容
5.将主族元素X的最高价氧化物X2O 4.7g溶于95.3g水中,所得溶液中溶质的质量分数为5.6%.Y与X在周期表中位于同一主族,Y的氢氧化物12g与400mL 0.75moL•L-1的盐酸恰好中和.Z与Y在周期表中位于同一周期,标准状况下5.6L ZO2气体的质量为16g.求X、Y、Z的相对原子质量.并分别写出它们原子的电子式.分析 主族元素X的最高价氧化物X2O,X处于IA族,溶于水生成XOH,由X原子守恒可知2n(X2O)=n(XOH),进而计算X相对原子质量;Y与X位于同一族,则Y也处于IA族,其氢氧化物为YOH,与盐酸发生中和反应,结合n(YOH)=n(HCl)计算Y相对分子质量;根据n=$\frac{V}{{V}_{m}}$ZO2的物质的量,再根据M=$\frac{m}{n}$计算ZO2的摩尔质量,进而确定Z的相对分子质量.结合相对分子质量可以确定X、Y元素符号,结合Z与Y同周期,可以确定Z的元素符号.
解答 解:主族元素X的最高价氧化物X2O,X处于IA族,溶于水生成XOH,4.7g X2O 溶于95.3g水中,得到溶质质量分数为5.6%的溶液,则XOH的质量=(4.7g+95.3g)×5.6%=5.6g,令X的相对原子质量为a,则根据X原子守恒:2×$\frac{4.7}{2a+16}$=$\frac{5.6}{a+17}$,解得a=39,
元素Y与X同主族,则Y也处于IA族,其氢氧化物为YOH,与盐酸发生中和反应,设Y的相对原子质量b,则$\frac{12g}{(b+17)g/mol}$=0.75mol/L×0.4L,解得b=23,
标况下ZO2的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,ZO2的摩尔质量为$\frac{16g}{0.25mol}$=64g/mol,则Z的相对分子质量为64-32=32,
X、Y处于IA族,X相对原子质量为39,Y的相对原子质量为23,则X为K,电子式为K•;Y为Na,电子式为Na•;Z的相对原子质量为32,且Z与Na同周期,故Z为S,电子式为
答:X相对原子质量为39,Y的相对原子质量为23,Z的相对原子质量为32;电子式分别为K•、Na•、 .
.
点评 本题考查结构性质位置关系应用、化学计算,侧重考查学生的分析理解能力及化学计算能力,注意对基础知识的理解掌握,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 该原电池的正极是锌 | B. | 铜电极发生还原反应 | ||
| C. | 原电池中Cu2+向锌极移动 | D. | 铜极有气体放出 |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 反应物的性质 | B. | 反应温度 | C. | 浓度 | D. | 压强 |
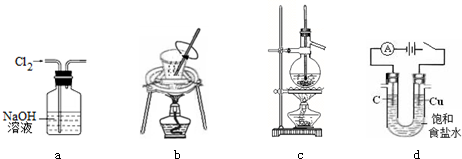
| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置进行从海带中提取碘实验时灼烧海带 | |
| C. | 用图c所示装置分离沸点相差较大的互溶液体混合物 | |
| D. | 用图d所示装置进行电解法制Cl2、H2 |
| A. | 在水中通入氯气:Cl2+H2O=Cl-+2H++ClO- | |
| B. | 二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 往氯化铝溶液中滴加过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 往氯化铁溶液中加入铜:Fe3++Cu=Cu2++Fe2+ |
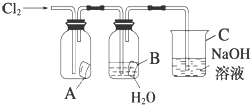 某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
某同学按图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.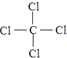 .
.