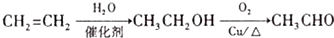题目内容
17.短周期元素X、Y、Z、W中,0.5mol X元素的离子得到6.02×1023个电子后被还原为中性原子,0.4g X的氧化物恰好与100mL 0.2mol•L-1的盐酸完全反应,X元素原子核内质子数与中子数相等;X可在Y的气态单质中燃烧,生成化合物X3Y2;Z单质常用于消毒杀菌;W元素原子最外层电子数是次外层的2倍.请填写下列空格:
(1)X、W两种元素的元素符号:XMg,WC.
(2)Z、W两元素组成的物质含有共价键(填“共价”或“离子”),其结构式是
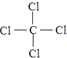 .
.(3)X、Y、Z三种元素的离子半径由大到小的顺序为Cl->N3->Mg2+(用离子符号表示).
(4)写出工业制备Z元素单质的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
分析 短周期元素X、Y、Z、W中,0.5mol的X元素的离子得到6.02×1023个电子时,被还原为中性原子,6.02×1023个电子为1mol,则离子为X2+,X的氧化物为XO,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由XO+2HCl═XCl2+H2O,可知XO的物质的量为$\frac{1}{2}$×0.1L×0.2mol/L=0.01mol,则M(XO)=$\frac{0.4g}{0.01mol}$=40g/mol,所以X的摩尔质量为40g/mol-16g/mol=24g/mol,又X原子核内质子数目与中子数目相等,则质子数为12,即X为Mg元素;X可在Y的气态单质中燃烧,生成化合物X3Y2,则Y为N元素;Z单质常用于消毒杀菌,则Z为Cl元素;W元素原子最外层电子数是次外层的2倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故W为C元素.
解答 解:短周期元素X、Y、Z、W中,0.5mol的X元素的离子得到6.02×1023个电子时,被还原为中性原子,6.02×1023个电子为1mol,则离子为X2+,X的氧化物为XO,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,由XO+2HCl═XCl2+H2O,可知XO的物质的量为$\frac{1}{2}$×0.1L×0.2mol/L=0.01mol,则M(XO)=$\frac{0.4g}{0.01mol}$=40g/mol,所以X的摩尔质量为40g/mol-16g/mol=24g/mol,又X原子核内质子数目与中子数目相等,则质子数为12,即X为Mg元素;X可在Y的气态单质中燃烧,生成化合物X3Y2,则Y为N元素;Z单质常用于消毒杀菌,则Z为Cl元素;W元素原子最外层电子数是次外层的2倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故W为C元素.
(1)X、W两种元素的元素符号分别为Mg、C,
故答案为:Mg;O;
(2)Z、W两元素组成的物质为CCl4,含有共价键,结构式为: ,
,
故答案为:共价; ;
;
(3)X、Y、Z三种元素的离子分别为Mg2+、N3-、Cl-,电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径由大到小的顺序为:Cl->N3->Mg2+,
故答案为:Cl->N3->Mg2+;
(4)工业制备氯气的离子方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物知识,掌握中学常见化学工业,难度不大.

| A. | NH4Cl | B. | [Cu(NH3)4]SO4 | C. | [Ag(NH3)2]NO3 | D. | CaCl2 |
| A. | 金属性:Na>Mg | B. | 热稳定性:HF>HCl | ||
| C. | 酸性:H2SO3>H2CO3 | D. | 氧化性:O2>S |
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 氧化铜和氧化亚铜都是黑色固体 | |
| C. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓盐酸 |
| A. | 过量的铁粉投入一定量的热浓硫酸中,将产生的气体通人浓NaOH溶液中,气体可全部被吸收 | |
| B. | 25℃下,pH=0的溶液中,A13+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Fe2+可以大量共存 | |
| C. | 检验红砖中的氧化铁,向红砖粉末中加人盐酸,充分反应后取上层清液于试管中,滴加2~3滴KSCN溶液即可 | |
| D. | 向CuSO4溶液中滴人过量NaOH溶液充分反应后,将混合溶液倒人蒸发皿中加热煮沸一段时间,然后冷却、过滤、滤纸上的物体为“蓝色固体” |
 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
. .
.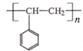 路线流程图(无机试剂任选).合成路线流程图示例如下:
路线流程图(无机试剂任选).合成路线流程图示例如下: