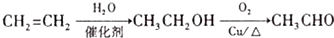题目内容
14.下列反应的离子方程式正确的是( )| A. | 在水中通入氯气:Cl2+H2O=Cl-+2H++ClO- | |
| B. | 二氧化硅与烧碱溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 往氯化铝溶液中滴加过量的氨水:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 往氯化铁溶液中加入铜:Fe3++Cu=Cu2++Fe2+ |
分析 A.次氯酸为弱电解质,离子方程式中次氯酸不能拆开;
B.二氧化硅与氢氧化钠溶液反应生成硅酸钠和水;
C.氨水为弱碱,二者反应生成氢氧化铝沉淀;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.在水中通入氯气,反应生成氯化氢和次氯酸,次氯酸小于保留分子式,正确的离子方程式为:Cl2+H2O=Cl-+H++HClO,故A错误;
B.二氧化硅与烧碱溶液反应生成硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,故B正确;
C.一水合氨为弱电解质,离子方程式中不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.氯化铁溶液中加入铜,反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu=Cu2++2Fe2+,故D错误;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
2.某元素X的最高价氧化物为X2O5,则它的气态氢化物是( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
9.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 氧化铜和氧化亚铜都是黑色固体 | |
| C. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓盐酸 |
19.下列说法正确的是( )
| A. | 乙醇分子中的氢原子均可被钠置换 | |
| B. | 乙醇能与钠反应放出氢气,说明乙醉能电离出H+而表现酸性 | |
| C. | 乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼 | |
| D. | 乙醇分子羟基中的氢原子比水分子中的氢原子活泼 |
16.日常生活中常见到的“加碘食盐”“含氟牙膏”等商品.其中碘、氟指的是( )
| A. | .单质 | B. | 元素 | C. | .分子 | D. | .离子 |
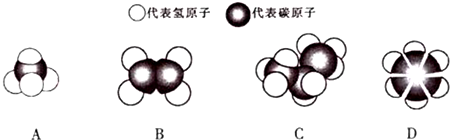
 +3H2$\stackrel{催化剂}{→}$
+3H2$\stackrel{催化剂}{→}$ .
. .
.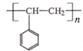 路线流程图(无机试剂任选).合成路线流程图示例如下:
路线流程图(无机试剂任选).合成路线流程图示例如下: