题目内容
10.用下列实验装置进行相应实验,装置正确且能达到实验目的是( )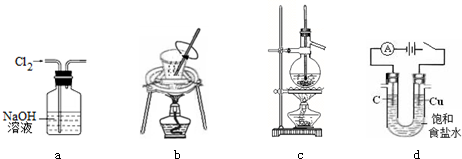
| A. | 用图a所示装置除去Cl2中含有的HCl | |
| B. | 用图b所示装置进行从海带中提取碘实验时灼烧海带 | |
| C. | 用图c所示装置分离沸点相差较大的互溶液体混合物 | |
| D. | 用图d所示装置进行电解法制Cl2、H2 |
分析 A.氯气和HCl都能和NaOH溶液反应;
B.灼烧海带需要在坩埚中进行,并用玻璃杯搅拌;
C.蒸馏装置中,温度计的水银球应该放在蒸馏烧瓶的支管口处;
D.如果用Cu作电解池阳极,则阳极上Cu失电子而不是电解质溶液中阴离子失电子.
解答 解:A.氯气和HCl都能和NaOH溶液反应,所以不能用NaOH溶液除去氯气中的HCl,应该用饱和食盐水,故A错误;
B.需要在坩埚中灼烧海带,能够用图b所示装置进行从海带中提取碘实验时灼烧海带,故B正确;
C.分离沸点相差较大的互溶液体混合物,需要通过蒸馏操作,温度计用于控制馏分温度,温度计的水银球应该放在蒸馏烧瓶的支管口处,图示装置中水银球的位置不合理,故C错误;
D.如果用Cu作电解池阳极,则阳极上Cu失电子而不是电解质溶液中阴离子失电子,所以得不到氯气,应该用石墨作阳极、Cu作阴极,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及电解原理、物质制备、仪器选取、除杂等知识点,明确实验原理及物质性质、实验操作规范性是解本题关键,注意从实验操作规范性、仪器用途、实验评价方面分析解答,易错选项是D.

练习册系列答案
相关题目
1.下列说法中错误的是( )
| A. | 乙醇分子结构中不存在手性碳 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | SO2、SO3都是极性分子 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、硬度大的特性 |
15.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 在精炼铜或电镀铜的过程中,当阳极析出铜64g转移电子数均为2NA | |
| B. | 24g石墨烯(单层石墨)中含有六元环的个数为NA | |
| C. | 1.0mo1•L-1的Na2CO3溶液中所含阴离子数大于NA个 | |
| D. | 1mol的甲基(-CH3)中所含的电子数为10NA |
2.某元素X的最高价氧化物为X2O5,则它的气态氢化物是( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
19.下列说法正确的是( )
| A. | 乙醇分子中的氢原子均可被钠置换 | |
| B. | 乙醇能与钠反应放出氢气,说明乙醉能电离出H+而表现酸性 | |
| C. | 乙醇分子羟基中的氢原子比乙烷分子中的氢原子活泼 | |
| D. | 乙醇分子羟基中的氢原子比水分子中的氢原子活泼 |