题目内容
3.TiO2在工业生产和日常生活中有重要用途.I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
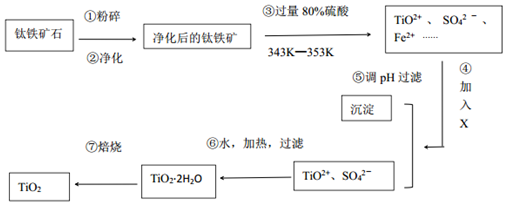
其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:Al2O3+2OH-=2AlO2-+H2O.
(2)④中加入的X可能是A
A.H2O2 B.KMnO4 C.KOH D.SO2
(3)④⑤两步的目的是除去亚铁离子.
(4)写出⑥的化学反应方程式TiOSO4+3H2O=TiO2•2H2O↓+H2SO4.
II、TiO2可通过下述两种方法制备金属钛:方法一是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.
(5)写出生成TiCl4的化学反应方程式TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO
方法二是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(6)阴极反应的电极反应式为TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti).
(7)电解过程中需定期向电解槽池中加入碳块的原因是碳单质会与阳极产生的氧气反应而不断减少.
分析 钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH-=2AlO2-+H2O、
SiO2+2OH-=SiO32-+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K-353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4,加入X并调节溶液的pH得到沉淀和TiO2+、SO42-,说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42-加热、过滤得到TiO2.2H2O,焙烧得到TiO2;
(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;
(2)④X应该具有强氧化性,且不能引进杂质;
(3)④⑤两步的目的是除去亚铁离子;
(4)⑥中TiO2+水解生成TiO2.2H2O;
(5)TiO2与Cl2、C反应得到TiCl4,同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁;
(6)阴极上得电子反应还原反应生成金属钛;
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳.
解答 解:钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH-=2AlO2-+H2O、
SiO2+2OH-=SiO32-+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K-353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4,加入X并调节溶液的pH得到沉淀和TiO2+、SO42-,说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42-加热、过滤得到TiO2.2H2O,焙烧得到TiO2;
(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,故选A;
(3)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,故答案为:除去亚铁离子;
(4)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO2•2H2O↓+H2SO4,
故答案为:TiOSO4+3H2O=TiO2•2H2O↓+H2SO4;
(5)TiO2与Cl2、C反应得到TiCl4,同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁,则生成四氯化钛的反应方程式为TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO,
故答案为:TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;
(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti),
故答案为:TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti);
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,
故答案为:碳单质会与阳极产生的氧气反应而不断减少.
点评 本题考查物质的分离提纯和制备,为高频考点,侧重考查学生对化学工艺流程的理解、分析、判断及对知识的综合运用能力,涉及除杂、氧化还原反应、电解原理等知识点,明确化学反应原理、元素化合物性质是解本题关键,易错点是(6)题电极反应式的书写.

| A. | 这个反应是氧化还原反应 | B. | 制造过程中元素种类发生改变 | ||
| C. | 另一种化合物为NaCl | D. | 金刚石属于金属单质 |
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
查阅资料得到以下有关高氯酸的信息:
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
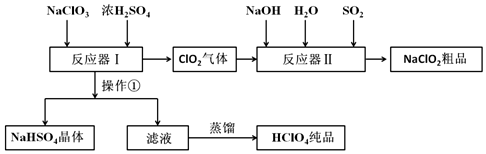
(1)操作①的名称是过滤.
(2))Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性
(3)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的为了产物能得到HClO4而不是NaClO4.
(4)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(5)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4.
| A. | 麦芽糖和蔗糖 | B. | 蛋白质和氨基酸 | C. | 油和脂 | D. | 淀粉和纤维素 |
| A. | 氧化铝 | B. | 氢氧化铝 | C. | 铝 | D. | 碳酸氢钠 |
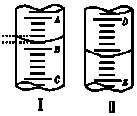 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.