题目内容
19.近年来,雾霾天气多次肆虐我国广大地区.其中,汽车尾气和燃煤是造成空气污染的主要原因之一.(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g);△H<0
①该反应的平衡常数表达式为$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$.
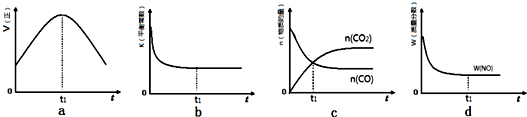
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是bd(选填代号).
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染.
已知:①CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g);△H=-867kJ/mol
②2NO2(g)?N2O4(g);△H=-56.9kJ/mol
③H2O(g)═H2O(l);△H=-44.0kJ/mol
请写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)甲烷燃料电池可以提升能量利用率.图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(假设电解后溶液体积不变).
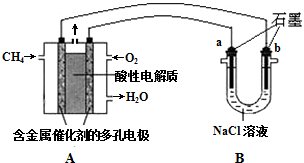
①甲烷燃料电池的负极反应为CH4-8e-+2H2O=CO2+8H+.甲烷燃料电池总反应化学方程式为CH4+2O2=2H2O+CO2.
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应).
③阳极产生气体的体积在标准状况下是1.68 L.
分析 (1)①根据反应方程式2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)及平衡常数的概念写出该反应的化学平衡常数表达式为K;
②a.达平衡后正、逆速率相等,且不再变化;
b.平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
c.1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
d.达平衡后各组分的含量不发生变化;
(2)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;电池中总反应为甲烷燃烧生成二氧化碳和水;
②根据氯化钠的物质的量及电解方程式来求溶液中生成的氢氧根离子浓度,再计算出溶液的pH;
③电解过程中,阳极先生成氯气,之后电解水过程中生成氧气,根据氢气的总物质的量判断阳极生成气体的总物质的量,然后计算出标况下的阳极生成气体的体积.
解答 解:(1)①反应方程式2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数表达式为:K=$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$,
故答案为:$\frac{c({N}_{2}){c}^{2}(C{O}_{2})}{{c}^{2}(NO){c}^{2}(CO)}$;
②a.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达到最高,平衡常数不变,故b正确;
c.t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d.t1时刻NO的质量分数为定值,说明NO的浓度、百分含量不再变化,即t1时刻已经达到平衡状态,故d正确,
故答案为:bd;
(2)已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H1=-867kJ/mol①
2NO2(g)?N2O4(g)△H2=-56.9kJ/mol②
H2O(g)=H2O(l)△H=-44.0kJ/mol③
根据盖斯定律,①-②+③×2可得CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l),故△H=-867kJ/mol-(-56.9kJ/mol)+2(-44.0)kJ/mol=-898.1kJ/mol 即CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol,
故答案为:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol;
(3)①、原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极电极反应式为:CH4-8e-+2H2O=CO2+8H+,甲烷燃料电池总反应化学方程式为CH4+2O2=2H2O+CO2,
故答案为:CH4-8e-+2H2O=CO2+8H+;CH4+2O2=2H2O+CO2;
②100mL 1mol/L食盐水中含有氯化钠0.1mol,根据反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解0.1molNaCl生成0.1mol氢氧化钠和0.05mol氢气,同时生成0.05mol氯气;继续电解实质为电解水,标况下2.24L氢气的物质的量为0.1mol,电解水生成氢气为0.1mol-0.05mol=0.05mol,生成0.05mol氢气会生成0.025mol氧气,则电解过程中阳极总共生成0.05mol+0.025mol=0.075mol气体,
电解生成标况下2.24L氢气时,生成氢氧化钠的物质的量为:0.1mol,此时溶液中氢氧根离子浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,溶液中氢离子浓度为:c(H+)=$\frac{1×1{0}^{-14}}{1}$=10-14mol/L,所以溶液的pH=14,
故答案为:14;
③根据②的分析可知,电解过程中阳极生成了0.05mol氯气和0.025mol氧气,总共生成0.075mol气体,标准状况下阳极生成气体的体积为:22.4L/mol×0.075mol=1.68,
故答案为:1.68.
点评 本题考查了化学平衡常数影响因素及计算、电解原理、热化学方程式的书写等知识,题目难度较大,试题涉及的知识点较多,充分培养了学生的分析、理解能力及化学计算能力,注意掌握化学平衡常数的概念、表达式及其影响因素,明确电解原理,能够正确书写电极反应式.

| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最简单氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度
B.移出部分CO2
C.加入合适的催化剂
D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.006 mol•L-1•min-1.
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
查阅资料得到以下有关高氯酸的信息:
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
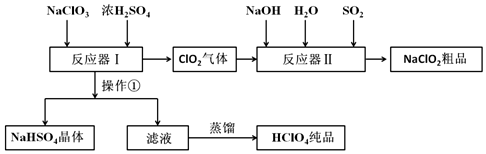
(1)操作①的名称是过滤.
(2))Ca(ClO)2、ClO2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂是因为它们都具有强氧化性
(3)反应器Ⅰ中投料时需加入过量浓硫酸,请简述目的为了产物能得到HClO4而不是NaClO4.
(4)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(5)某学习小组模拟工业流程图中的蒸馏过程,有液体流出时立即收集产品以获得HClO4纯品.请评价这一操作是否合理并说明理由不合理,因为水的沸点是100℃,HClO4的沸点是130℃,所以最先蒸馏流出的是水而不是HClO4.
 CO2与H2合成甲醚的主要反应如下:
CO2与H2合成甲醚的主要反应如下: 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.