题目内容
13.用标准的KOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是( )①配制标准溶液的固体KOH中混有NaOH杂质.②滴定终点读数时,俯视滴定刻度,其他操作正常.③盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗.④滴定到终点读数时,发现滴定管尖挂一滴溶液.⑤用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液.⑥用含Na2CO3杂质的NaOH固体配制已知浓度的标准溶液.
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑥ | D. | ③④⑥ |
分析 根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差.
解答 解:①配制标准溶液的固体KOH中混有NaOH杂质,相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配得溶液的OH-浓度偏大,造成消耗标准液体积偏小,溶液浓度偏低,故选;
②滴定终点读数时,俯视滴定刻度,其他操作正常,导致消耗标准液体积偏小,溶液浓度偏低,故选;
③盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗,导致消耗标准液体积偏大,溶液浓度偏高,故不选;
④滴定到终点读数时,发现滴定管尖挂一滴溶液,导致消耗的标准液体积偏大,溶液浓度偏高,故不选;
⑤用用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,造成V(标准)偏小,溶液浓度偏低,故选;
⑥用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,造成V(标准)偏大,溶液浓度偏高,故不选;
故选:B.
点评 本题主要考查酸碱滴定实验的基本操作,侧重于学生的分析能力和实验能力的考查,难度不大,学生应注意操作的规范性和实验中常见的误差分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.仅用下列装置和表中所提供的物质(不考虑尾气处理,必要时可加热),能收集所制备的气体且能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 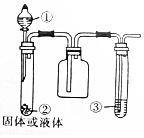 |
| A | 浓氨水 | 生石灰 | 石蕊试液 | 氨气是碱性气体 | |
| B | 浓硝酸 | 铜片 | 淀粉-KI溶液 | NO2水溶液具有氧化性 | |
| C | 浓硫酸 | 亚硫酸钠 | 酸性高锰酸钾溶液 | SO2具有漂白性 | |
| D | 浓盐酸 | 二氧化锰 | 紫色石蕊试液 | 氯气具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
18.下列说法中,正确的是( )
| A. | 等浓度CH3COOH溶液与NH3•H2O溶液等体积混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等浓度的HCl溶液与CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一浓度的HCl溶液时,其pH会改变 | |
| D. | 等浓度的CH3COOH溶液和NaOH溶液等体积混合后,溶液显中性 |
2.下列变化不能通过一步反应实现的是( )
| A. | SO2→H2SO3 | B. | SiO2→H2SiO3 | C. | SO2→S | D. | S→SO3 |
3.下列离子检验的步骤、现象和结论都正确的是( )
| A. | 向试液中滴加氯化钡溶液,产生白色沉淀,则溶液中一定含有CO32- | |
| B. | 向试液中滴加浓氢氧化钠溶液,加热产生刺激性气味的气体,则溶液中一定含有NH4+ | |
| C. | 向试液中滴加硝酸银溶液,产生白色沉淀,则溶液中一定含有Cl- | |
| D. | 向试液中滴加盐酸,产生的气体能使品红溶液褪色,则溶液中一定含有SO32- |
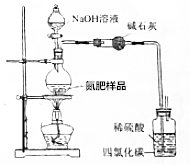 用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).
用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解).