题目内容
3.某烃在标准状况下密度为0.717g/L,碳元素的质量分数为75%,试回答下列问题:(1)该烃的分子式为CH4.
(2)该烃在空气中燃烧的化学方程式为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.
分析 某烃在标准状况下密度为0.717g/L,其M=0.717g/L×22.4L/mol=16g/mol,C原子个数为$\frac{16×75%}{12}$=1,则有机物为CH4,燃烧生成二氧化碳和水,以此来解答.
解答 解:(1)某烃在标准状况下密度为0.717g/L,其M=0.717g/L×22.4L/mol=16g/mol,C原子个数为$\frac{16×75%}{12}$=1,即有机物含1个C、4个H,则有机物为CH4,
故答案为:CH4;
(2)该烃在空气中燃烧的化学方程式为CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
故答案为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O.
点评 本题考查有机物分子式计算的确定,为高频考点,把握M的计算及原子个数计算为解答本题的关键,侧重分析与计算的考查,注意烃的性质,题目难度不大.

练习册系列答案
相关题目
20.化学与生产和生活密切相关.下列有关说法正确的是( )
| A. | 硅太阳能电池利用的是原电池原理 | B. | 草木灰与硝酸铵混成复合肥施用 | ||
| C. | 硅胶可用作瓶装药品的干燥剂 | D. | 用于发酵的小苏打属于碱 |
1.锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是( )
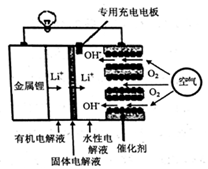

| A. | 正极区产生的LiOH可回收利用 | |
| B. | 电池中的有机电解液可以用稀盐酸代替 | |
| C. | 该电池放电时,正极的反应式为O2+4e-+4H+=2H2O | |
| D. | 该电池充电时,阴极发生了氧化反应:Li++e-=Li |
18.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA | |
| C. | CO2通过Na2O2使其增重a g时,反应中转移的电子数为$\frac{a}{56}$NA | |
| D. | 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA |
5.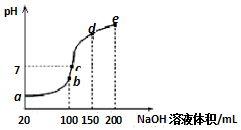 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )| A. | b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 图中b、c、d、三点溶液中水的电离程度最大的是c点 | |
| C. | b点后滴加NaOH溶液过程中,NH3•H2O的电离程度逐渐减小 | |
| D. | pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
15.关于Cl-和Cl2的说法正确的是( )
| A. | 都能与Fe反应生成FeCl3 | B. | 与AgNO3溶液反应都生成白色沉淀 | ||
| C. | 均有毒 | D. | 都具有氧化性 |
12.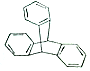 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
 2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )
2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家共同获得,以表彰他们在“分子马达”研究方面的成就.最初的“分子马达”的关键组件是三叠烯(如图),下列有关三叠烯的说法正确的是( )| A. | 分子式为C20H14 | B. | 属于苯的同系物 | ||
| C. | 能与溴水发生加成反应 | D. | 分子中所有原子可能在同一平面上 |