题目内容
8.实验室里将32克铜与100mL一定浓度的硝酸恰好完全反应,产生的NO和NO2混合气体在标况下的体积为13.44L,计算:(1)能生成多少升NO(标准状况下)?
(2)被还原的HNO3的物质的量?
(3)硝酸的物质的量浓度是多少?
(4)将铜和硝酸产生的气体收集于一倒置于水槽的容器中,欲使水充满整个容器,应向容器中通入标准状况下O2多少升?
分析 n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,铜与浓硝酸反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,稀硝酸与铜反应生成NO,NO2、NO的物质的量共为:$\frac{13.44L}{22.4L/mol}$=0.6mol,
(1)设混合气体中含有NOxmol,则含有二氧化氮为(0.6-x)mol,根据电子守恒计算出NO的物质的量,最高价V=nVm计算出标准状况下NO体积;
(2)被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量;
(3)n(Cu)=0.5mol,反应后生成Cu(NO3)2、NO和NO2,且NO和NO2的物质的量总共为0.6mol,据此可计算出硝酸的总物质的量,然后根据c=$\frac{n}{V}$计算出该硝酸的物质的量浓度;
(4)若要使水恰好充满容器,则NO2、NO与氧气和水完全反应生成硝酸,根据电子守恒可知硝酸与铜反应得到电子的物质的量应等于O2氧化NO2、NO生成硝酸得到电子的物质的量,也等于0.5molCu失去电子的物质的量,根据关系式2Cu~O2计算出氧气的体积.
解答 解:n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,铜与浓硝酸反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,稀硝酸与铜反应生成NO,NO2、NO的物质的量共为:$\frac{13.44L}{22.4L/mol}$=0.6mol,
(1)设混合气体中含有NOxmol,则含有二氧化氮为(0.6-x)mol,根据电子守恒可得:0.5mol×2=(5-2)x+(0.6-x)×(5-4),解得:x=0.2mol,
标准状况下0.2molNO气体的体积为:22.4L/mol×0.2mol=4.48L,
答:生成NO气体在标准状况下的体积为4.48L;
(2)NO2、NO的物质的量共0.6mol,被还原的硝酸的物质的量等于生成NO2、NO的总的物质的量,为0.2mol,
答:被还原的HNO3的物质的量为0.6mol;
(3)n(Cu)=0.5mol,反应后生成Cu(NO3)2、NO和NO2,且NO和NO2的物质的量总共为0.6mol,则反应中消耗HNO3的物质的量为:2n(Cu(NO3)2)+n(NO)+n(NO2)=2×0.5mol+0.6mol=1.6mol,
所以原硝酸的物质的量浓度为:$\frac{1.6mol}{0.1L}$=16mol/L,
答:原硝酸的物质的量浓度16mol/L;
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,则NO2、NO与氧气和水完全反应生成硝酸,根据电子守恒可知硝酸与铜反应得到电子的物质的量应等于O2氧化NO2、NO生成硝酸得到电子的物质的量,也等于0.5molCu失去电子的物质的量,
设需通入O2的体积为x,由电子守恒,可得:
2Cu~O2
2mol 22.4L
0.5mol x
2mol:22.4L=0.5mol:x
解得:x=5.6L,
答:理论上需要通入O2的在标准状况的体积是5.6L.
点评 本题考查氧化还原反应的计算,题目难度中等,注意把握硝酸的性质,解答本题的关键是把握氧化还原反应的特点:氧化剂和还原剂得失电子数目相等,(4)为易错点,答题时注意从守恒的角度入手思考.

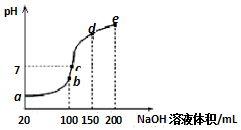 常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )
常温下,现向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生).下列说法正确的是( )| A. | b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 图中b、c、d、三点溶液中水的电离程度最大的是c点 | |
| C. | b点后滴加NaOH溶液过程中,NH3•H2O的电离程度逐渐减小 | |
| D. | pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
| A. | NaOH | B. | CuSO4 | C. | HCl | D. | NaCl |
| A. | 该反应中还原剂是C,还原产物有两种 | |
| B. | 若有32g硫参加反应,则被硫氧化的碳单质物质的量为3mol | |
| C. | 若在标准状况下生成8.96L气体,则转移的电子数为1.2NA | |
| D. | 产物中的两种气体在一定条件下都能够和Mg发生反应 |
| A. | 氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入过量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氢钠溶液中加入过量氢氧化钡溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 葡萄糖用于医疗输液是因为它属于强电解质 | |
| C. | Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |