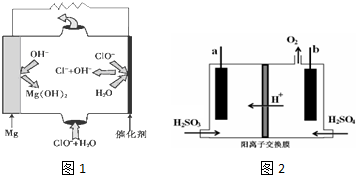
题目内容
9.直接排放含SO2的烟气会形成酸雨,危害环境.某化学实验小组进行如下有关SO2性质的探究活动.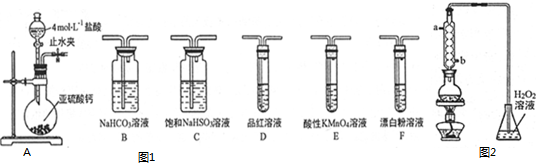
(1)写出利用如图1装置A中产生的气体证明+4价的硫元素具有氧化性的实验方案:将纯净的SO2通入氢硫酸溶液溶液中,出现淡黄色沉淀,证明+4价硫具有氧化性.
(2)选用以上装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按照A→C→F顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是二氧化硫通入次氯酸钙溶液发生了氧化还原反应不能证明强酸制备弱酸的原理.
②丙同学设计的合理实验方案为:A→C→B→E→D→F→尾气处理(填字母).其中装置C的作用昌除去HCl气体以免影响后面的实验测得.证明亚硫酸酸性强于次氯酸的实验现象是装置D中品红溶液不褪色,F中出现白色沉淀.
(3)利用如图2的装置可测定装置A残液中SO2的含量.量取1.00mL残液于烧瓶中,加适量蒸馏水稀释,加热使SO2全部逸出并与锥形瓶中的H2O2溶液恰好完全反应,然后用浓度为0.1000mol•L-1NaOH标准溶液进行滴定,至终点时记录数据.重复滴定2次,平均消耗NaOH溶液的体积为20.00mL.
①该装置中球形装冷凝管的冷凝水进口为b(填“a”或“b”).
②残液中SO2的含量为64.00g•L-1.
分析 (1)二氧化硫与氢硫酸反应生成硫,反应中二氧化硫表现氧化性;
(2)①按照A→C→F顺序连接装置,其中饱和的亚硫酸氢钠除去HCl,二氧化硫通入次氯酸钙溶液发生了氧化还原反应;
②次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中;
(3)①采取逆流原理通入冷凝水;
②根据关系式:SO2~H2SO4~2NaOH计算.
解答 解:(1)二氧化硫与氢硫酸反应生成硫,反应中二氧化硫表现氧化性,利用装置1中产生的气体证明+4价硫具有氧化性:将SO2通入氢硫酸溶液中,出现淡黄色沉淀,证明+4价硫具有氧化性,
故答案为:将纯净的SO2通入氢硫酸溶液溶液中,出现淡黄色沉淀,证明+4价硫具有氧化性;
(2)①按照A→C→F顺序连接装置,其中饱和的亚硫酸氢钠除去HCl,二氧化硫通入次氯酸钙溶液发生了氧化还原反应,不能证明强酸制备弱酸的原理,不能证明亚硫酸和次氯酸的酸性强弱,
故答案为:二氧化硫通入次氯酸钙溶液发生了氧化还原反应不能证明强酸制备弱酸的原理;
②次氯酸具有强氧化性、二氧化硫具有还原性,不能利用二氧化硫与次氯酸钙直接反应判断亚硫酸与次氯酸的酸性强弱,先验证亚硫酸酸性比碳酸强,再结合碳酸酸性比HClO强碱性判断.A装置制备二氧化硫,由于盐酸易挥发,制备的二氧化硫中混有HCl,用饱和的亚硫酸氢钠除去HCl,再通过碳酸氢钠溶液,可以验证亚硫酸酸性比碳酸强,用酸性高锰酸钾溶液氧化除去二氧化碳中的二氧化硫,用品红溶液检验二氧化碳中二氧化硫是否除尽,再通入F中,则装置连接顺序为A、C、B、E、D、F,其中装置C的作用是除去HCl气体,D中品红不褪色,F中出现白色沉淀,可证明亚硫酸的酸性强于次氯酸,
故答案为:B、E;除去HCl气体以免影响后面的实验测得;装置D中品红不褪色,F中出现白色沉淀;
(3)①采取逆流原理通入冷凝水,即球形冷凝管进水口为b,
故答案为:b;
②设残液中SO2含量为xg.L-1,则:
SO2~~H2SO4~~2NaOH
64g 2mol
xg.L-1×0.001L 0.02L×0.1mol/L
所以64g:xg.L-1×0.001L=2mol:0.02L×0.1mol/L
解得x=64.00
故答案为:64.00.
点评 本题考查气体制备与性质实验、物质含量测定实验,涉及装置分析与评价、实验方案设计、仪器使用、化学计算等,关键是明确实验原理,较好的考查学生实验综合能力与知识迁移应用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| X | Y | Z | W | R | P | Q | |
| 原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是bc(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(5)反应3X2(g)+P2(g) 2PX3(g)过程中的能量变化如图所示,回答下列问题.
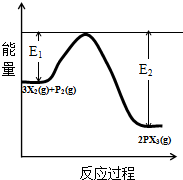
①该反应是放热反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?不影响,原因是催化剂不改变平衡的移动(从能量说明)
| 次数 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 50 | 50 |
| 剩余固体的质量/g | 2.6 | 1 |
(1)合金中镁的质量为4g;
(2)所用稀盐酸的溶质质量分数.
| A. | (c-a-b)kJ | B. | (a+b-c)kJ | C. | (2c-a-b)kJ | D. | $\frac{2c-a-b}{2}$kJ |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |

| A. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1 mol CH4转移12 mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
 △H=+88.6kJ/mol
△H=+88.6kJ/mol