题目内容
9. 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
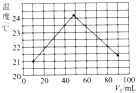
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
分析 (1)根据中和热测定的实验步骤选用需要的仪器,然后判断还缺少的仪器;
(3)①中和热测定实验中需要温度计测量开始时酸、碱的温度和反应后的最高温度;
②先判断温度差的有效性,根据公式Q=cm△T来求出生成0.025mol的水放出热量,根据中和热的概念求出中和热,最后写出热化学方程式;
③从图示观察的起始温度即为实验时的温度;
(4)a.依据Q=m•c•△T来逐项分析;
A.实验装置保温、隔热效果差,热量散失,导致反应后的温度低;
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,导致开始时温度偏高;
C.量取NaOH溶液的体积时仰视读数,导致放出的热量多;
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低;
b.根据中和热的概念和实质来回答;根据弱电解质电离吸热.
解答 解:(1)中和热的测定过程中,需要用量筒量取酸溶液、碱溶液的体积,需要使用温度计测量温度,环形玻璃棒搅拌棒搅拌混合溶液,所以还缺少环形玻璃棒搅拌棒和量筒;
故答案为:环形玻璃棒搅拌;量筒;
(3)①t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是反应后的最高温度;
故答案为:反应后的最高温度;
②50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液混合,氢氧化钠过量,反应生成了0.025mol水,
第1次反应前后温度差为:3.3℃;第2反应前后温度差为:3.5℃,均有效,温度差的平均值为3.4℃,50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液的质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1.4212kJ,即生成0.025mol的水放出热量1.4212kJ,所以生成1mol的水放出热量为1.4212kJ×$\frac{1mol}{0.025mol}$=-56.848 kJ,即该实验测得的中和热△H=-56.848 kJ•mol-1,NaOH溶液与HCl溶液反应的热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848 kJ•mol-1;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848 kJ•mol-1;
③根据实验图象所示,22℃是加入10mL氢氧化钠或盐酸反应后的温度,可知该实验开始时温度一定是低于22℃;
故答案为:低于;
(4)a.A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料,热量散失,导致反应后的温度低,△T偏小,由Q=m•c•△T,可知测量结果偏低,故A错误;
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度,导致开始时温度偏高,△T偏小,由Q=m•c•△T,可知测量结果偏低,故B错误;
C.量取NaOH溶液的体积时仰视读数,放出的热量多,△T偏大,由Q=m•c•△T,可知测量结果偏高,故C正确;
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中,热量散失,导致反应后的温度低,△T偏小,由Q=m•c•△T,可知测量结果偏低,故D错误;
故选C.
b.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,所以用用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,测得的中和热的数值无影响;醋酸为弱酸,电离过程为吸热过程,所以用醋酸代替HCl,反应放出的热量偏小,中和热的数值会偏小;
故答案为:相等;有.
点评 本题考查中和热的测定原理,题目难度中等,注意理解中和热的概念是解题的关键.

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 0.35mol | B. | 0.7mol | C. | 0.3mol | D. | 0.5mol |
| A. | 玻璃钢 | B. | 钢化玻璃 | C. | 有机玻璃 | D. | 石英玻璃 |
| A. | 蛋白质的盐析是可逆过程 | |
| B. | 变性是蛋白质的凝固 | |
| C. | 盐析和变性都能够改变蛋白质的性质 | |
| D. | 盐析和变性都可以通过加入盐来实现 |
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 蛋自质和纤维素水解的最终产物都是氨基酸 | |
| C. | 油脂、纤维素、淀粉在一定条件下均可发生水解反应 | |
| D. | 油脂、纤维素、淀粉都是高分子化合物 |
| A. | 加入醋酸钠固体 | B. | 加入盐酸 | C. | 加入蒸馏水 | D. | 升高温度 |

 ,A分子中最多在同一平面的原子数为16;
,A分子中最多在同一平面的原子数为16;

 +H2O→
+H2O→


 .
.