题目内容
14.化学与我们的生活、生产密切相关,请试用所学过的 化学方程式 表示:(1)食品包装袋中的干燥剂(主要成分是氧化钙)有防潮作用.CaO+H2O═Ca(OH)2
(2)有些治胃酸过多的药中含有氢氧化铝Al(OH)3,它在人的胃中起中和作用.Al(OH)3+3HCl═AlCl3+3H2O.
分析 (1)CaO易吸水,能和水反应生成氢.氧化钙;
(2)氢氧化铝为弱碱,能和胃酸-盐酸发生酸碱中和反应,生成氯化铝和水
解答 解:(1)氧化钙与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.故答案为:CaO+H2O═Ca(OH)2;
(2)胃酸过多时,可以服用能与盐酸反应的物质来治疗胃酸过多,如氢氧化铝,反应的化学方程式为:Al(OH)3+3HCl═AlCl3+3H2O;故答案为:Al(OH)3+3HCl═AlCl3+3H2O.
点评 本题主要考查化学方程式的书写和生产、生活和科研中的一些常识,难度较小,注意化学在生活中的应用.

练习册系列答案
相关题目
10.工业上用洗净的废铜屑作原料来制备硝酸铜.下列设计路线符合“绿色化学”思想的是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu $\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$ Cu(NO3)2 | D. | Cu$\stackrel{浓硫酸}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
2.下列属于多糖的是( )
| A. | 葡萄糖 | B. | 蔗糖 | C. | 淀粉 | D. | CH3COOH |
9. 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.
(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
已知:中和热计算公式为△H=-$\frac{(4.18×1{0}^{-3})•{m}_{总}•({t}_{2}-{t}_{1})}{n({H}_{2}O)}$kJ•mol-1
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
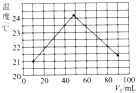
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
19.现代以石油化工为基础的三大合成材料是( )
①合成氨②塑料 ③医药 ④合成橡胶 ⑤合成尿素 ⑥合成纤维⑦合成洗涤剂.
①合成氨②塑料 ③医药 ④合成橡胶 ⑤合成尿素 ⑥合成纤维⑦合成洗涤剂.
| A. | ②④⑦ | B. | ②④⑥ | C. | ①③⑤ | D. | ④⑤⑥ |




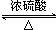 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
 ,该反应类型是取代反应.
,该反应类型是取代反应.