题目内容
18.在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使电离平衡右移且溶液中c(OH-)增大,应采取的措施是( )| A. | 加入醋酸钠固体 | B. | 加入盐酸 | C. | 加入蒸馏水 | D. | 升高温度 |
分析 CH3COOH?CH3COO-+H+,要使电离平衡右移且溶液中c(OH-)增大,则不能增大CH3COO-、H+的浓度,且电离为吸热反应,以此来解答.
解答 解:A.加入醋酸钠固体,CH3COO-的浓度增大,平衡向左移动,故A不选;
B.加入盐酸,H+的浓度增大,平衡向左移动,故B不选;
C.加入蒸馏水,促进电离,平衡右移且溶液中c(H+)减小,由Kw不变可知c(OH-)增大,故C选;
D.电离为吸热反应,则升高温度,平衡右移且溶液中c(H+)增大,故D不选;
故选C.
点评 本题考查弱电解质的电离平衡,为高频考点,把握影响电离平衡的因素为解答的关键,侧重分析与应用能力的考查,注意加水与升高温度均促进弱电解质的电离,题目难度不大.

练习册系列答案
相关题目
14.下列盐中,不能水解的是( )
| A. | K2SO4 | B. | AlCl3 | C. | K2S | D. | CH3COONH4 |
9. 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.
(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
已知:中和热计算公式为△H=-$\frac{(4.18×1{0}^{-3})•{m}_{总}•({t}_{2}-{t}_{1})}{n({H}_{2}O)}$kJ•mol-1
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
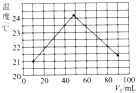
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
10.表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
请按要求回答下列问题:
(1)元素②在周期表中的位置为第二周期第IVA族
(2)④、⑤两种元素相比较,金属性强的是Na(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(4)元素④和元素⑥形成的化合物的电子式为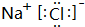 .
.
(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式HCl+NH3═NH4Cl.
| ① | ||||||||
| ② | ③ | |||||||
| ④ | ⑤ | ⑥ | ||||||
(1)元素②在周期表中的位置为第二周期第IVA族
(2)④、⑤两种元素相比较,金属性强的是Na(填元素符号);
(3)这些元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式,下同),具有两性的是Al(OH)3.
(4)元素④和元素⑥形成的化合物的电子式为
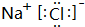 .
.(5)元素③和元素⑥的氢化物均极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式HCl+NH3═NH4Cl.
8. 下列实验能获得成功的是( )
下列实验能获得成功的是( )
 下列实验能获得成功的是( )
下列实验能获得成功的是( )| A. | 用如图所示装置,无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 | |
| C. | 水和乙醇的混合液,可用蒸馏的方法使其分离 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可观察到有银镜出现 |

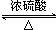 CH3COOC2H5+H2O.
CH3COOC2H5+H2O. 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.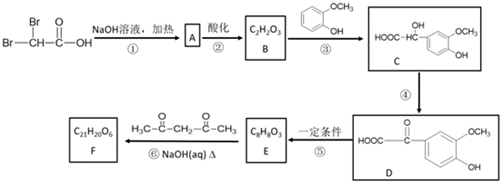
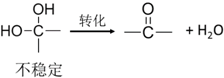

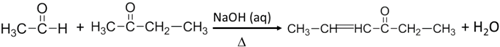
 .反应④的化学方程式是
.反应④的化学方程式是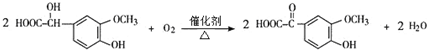 .
.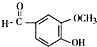 .F的结构简式是
.F的结构简式是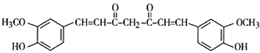 .
.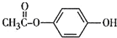 .
.