题目内容
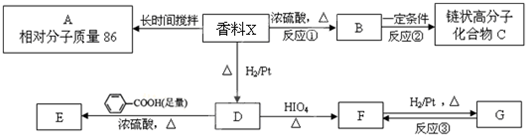
5.某糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣.对甘蔗渣进行综合利用,不仅可以提高经济效益,而且还可以防止环境污染.现按下列方式进行综合利用.已知H是具有香味的液体,试填空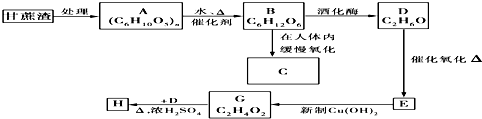
(1)A的名称是纤维素;H的名称为乙酸乙酯,其同类物的异构体还有(写结构简式)HCOOCH2CH2CH3,HCOOCH(CH3)2,CH3CH2COOCH3.
(2)写出下列化学方程式及反应类型:
D→E:2CH3CH2OH+O2$→_{△}^{CuO}$2CH3CHO+2H2O,氧化反应.
G→H:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应.
分析 甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,所以A是纤维素,B是葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇,则D是乙醇,D发生催化氧化生成E为CH3CHO,E进一步发生氧化反应生成G为CH3COOH,H是具有香味的液体,G与D发生酯化反应生成H为CH3COOCH2CH3,以此解答.
解答 解:甘蔗渣处理之后得到纤维素,纤维素水解的最终产物为葡萄糖,所以A是纤维素,B是葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇,则D是乙醇,D发生催化氧化生成E为CH3CHO,E进一步发生氧化反应生成G为CH3COOH,H是具有香味的液体,G与D发生酯化反应生成H为CH3COOCH2CH3.
(1)根据上面的分析可知,A的名称是纤维素,H的名称是乙酸乙酯,其同分异构体还有HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3CH2COOCH3,
故答案为:纤维素;乙酸乙酯;HCOOCH2CH2CH3、HCOOCH(CH3)2、CH3CH2COOCH3;
(2)D→E的化学方程式为2CH3CH2OH+O2$→_{△}^{CuO}$2CH3CHO+2H2O,为氧化反应;G→H的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,为酯化反应.故答案为:2CH3CH2OH+O2$→_{△}^{CuO}$2CH3CHO+2H2O,氧化反应;CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应.
点评 本题考查有机物的推断,为高频考点,侧重学生的分析能力的考查,题目难度不大,本题注意D为解答该题的关键,根据乙醇的性质进行推断,易错点为同分异构体的判断,注意不要漏写.

练习册系列答案
相关题目
15.下列事实能用影响化学反应速率的外界条件来解释的是( )
| A. | 镁和锌分别与相同浓度的盐酸反应,镁产生H2的速率快 | |
| B. | 铜与浓硝酸反应生成NO2,与稀硝酸反应生成NO | |
| C. | 用加热的方法可以将水中溶解的O-和N2赶出 | |
| D. | 面粉加工厂内充满粉尘,遇火易发生爆炸 |
16.下列表示方法正确的是( )
| A. | O2-的结构示意图: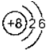 | |
| B. | 四氯化碳的电子式: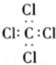 | |
| C. | HClO的结构式为:H-O-Cl | |
| D. | 用电子式表示氯化氢分子的形成过程: |
13.2002 年,科学家获得了 6 个非常罕见的 Fe-45 原子,这 6 个原子中发生了双质子衰变,既由一个原子核同时放出两个质子的衰变方式,以下有关原子${\;}_{26}^{45}$Fe的说法正确的是( )
| A. | 该原子中子数与质子数之差为 19 | |
| B. | 他们获得了一种新元素 | |
| C. | ${\;}_{26}^{45}$Fe与${\;}_{26}^{56}$Fe的化学性质几乎完全相同 | |
| D. | 这种铁原子衰变出 2 个质子后变成${\;}_{26}^{43}$Fe |
20.在实验室中,下列除去杂质的方法正确的是( )
| A. | 苯中混有溴,加入KI 溶液,振荡,用 CCl4萃取出溴 | |
| B. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓 HNO3 和浓 H2SO4,将其倒入到 NaOH 溶液中,静置,分液 | |
| D. | 乙烯中混有 SO2,将其通入酸性 KMnO4 溶液中洗气 |
10.工业上用洗净的废铜屑作原料来制备硝酸铜.下列设计路线符合“绿色化学”思想的是( )
| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu $\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$ Cu(NO3)2 | D. | Cu$\stackrel{浓硫酸}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
14.下列盐中,不能水解的是( )
| A. | K2SO4 | B. | AlCl3 | C. | K2S | D. | CH3COONH4 |
9. 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.
(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
已知:中和热计算公式为△H=-$\frac{(4.18×1{0}^{-3})•{m}_{总}•({t}_{2}-{t}_{1})}{n({H}_{2}O)}$kJ•mol-1
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
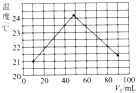
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.

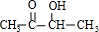 、C
、C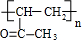 ;
;

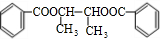 +2H2O.
+2H2O.