题目内容
4.下列对盐析和变性的说法不正确的是( )| A. | 蛋白质的盐析是可逆过程 | |
| B. | 变性是蛋白质的凝固 | |
| C. | 盐析和变性都能够改变蛋白质的性质 | |
| D. | 盐析和变性都可以通过加入盐来实现 |
分析 A.蛋白质的盐析是蛋白质溶液中加浓无机盐溶液,使蛋白质析出,加水又能溶解,是可逆的;
B.蛋白质经强酸、强碱作用发生变性后,仍能溶解于强酸或强碱溶液中,若将pH调至等电点,则变性蛋白质立即结成絮状的不溶解物,此絮状物仍可溶解于强酸和强碱中,如再加热则絮状物可变成比较坚固的凝块,此凝块不易再溶于强酸和强碱中,这种现象称为蛋白质的凝固作用;
C.盐析是物理变化,发生盐析的物质加水还能溶解,盐析是可逆的,未改变性质;
D.重金属盐能使蛋白质变性;浓无机盐能使蛋白质盐析;
解答 解:A.蛋白质溶液中加浓无机盐溶液发生盐析,使蛋白质析出,加水又能溶解,盐析是可逆的,故A正确;
B.蛋白质的凝固是变性所致,变性是蛋白质的凝固,故B正确;
C.盐析是物理变化,是可逆的,未改变性质;变性能够改变蛋白质的性质,不可逆,故C错误;
D.盐析和变性都可以通过加入盐来实现,重金属盐能使蛋白质变性,浓无机盐能使蛋白质盐析,故D正确;
故选C.
点评 本题考查蛋白质的性质,题目难度不大,注意是盐析和变性、凝固的区别是解题的关键.

练习册系列答案
相关题目
20.在实验室中,下列除去杂质的方法正确的是( )
| A. | 苯中混有溴,加入KI 溶液,振荡,用 CCl4萃取出溴 | |
| B. | 乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓 HNO3 和浓 H2SO4,将其倒入到 NaOH 溶液中,静置,分液 | |
| D. | 乙烯中混有 SO2,将其通入酸性 KMnO4 溶液中洗气 |
1.已知0.3mol•L-1酒精溶液的密度为ρ1 g•mL-1,0.1mol•L-11酒精溶液的密度为ρ2 g•mL-1,其中ρ1<ρ2,若将上述两溶液等质量混合,所得酒精溶液的物质的量浓度是( )
| A. | 大于0.2mol•L-1 | B. | 等于0.2mol•L-1 | C. | 小于0.2mol•L-1 | D. | 无法估算 |
9. 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.
(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
已知:中和热计算公式为△H=-$\frac{(4.18×1{0}^{-3})•{m}_{总}•({t}_{2}-{t}_{1})}{n({H}_{2}O)}$kJ•mol-1
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
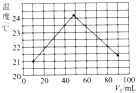
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
 某化学兴趣小组要完成中和热的测定.
某化学兴趣小组要完成中和热的测定.(1)实验仪器、药品:
实验桌上备有大、小两个烧杯、温度计、泡沫塑料、泡沫塑料板、胶头滴管、0.50mol•L-1盐酸、0.55mol•L-1NaOH溶液,实验尚缺少的玻璃用品是环形玻璃棒搅拌、量筒;
(2)实验原理:
该小组用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液,在组装好的装置中进行中和反应,并通过 测定反应过程中所放出的热量计算中和热.
(3)实验数据如下:
| 实验编号 | 实验用品 | 溶液温度 | 中和热 | |
| t2-t1 | △H | |||
| ① | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.3℃ | ? |
| ② | 50mL0.55mol•L-1NaOH溶液 | 50mL0.50mol•L-1盐酸 | 3.5℃ | |
①表中t1为氢氧化钠溶液和盐酸的初始温度的平均值,则t2的意义是
反应后的最高温度.
②根据公式,计算实验结果后写出NaOH溶液与HCl溶液反应的热化学方程式HCl(aq)+NaOH(aq)=NaCl(aq)+2H2O(l)△H=-56.848kJ•mol-1.
③实验过程中始终保持V1(氢氧化钠溶液)+V2(盐酸)=100mL.测量并记录溶液温度如图所示.
分析该图象得出如下两点结论:
酸碱中和反应为放热反应;做该实验时环境温度低于21℃(填“高于”“等于”或“低于”).
(4)相关误差分析
a.中和热测定的实验,测量结果偏高的原因可能是C(填选项字母).
A.由于大小烧杯间空隙过大,填充了很多的泡沫塑料
B.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
C.量取NaOH溶液的体积时仰视读数
D.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
b.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,从理论上说所求中和热相等(填“相等”或“不相等”);若用醋酸代替HCl做实验,对测定结果有(填“有”或“无”)影响.
16.LED灯既能节能、亮度又好.图是某课外活动小组设计的用化学电源使LED灯发光的装置.下列说法正确的是( )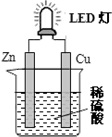

| A. | 锌片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将硫酸换成柠檬汁,导线中就不会有电子流动 | |
| D. | 如果将铜片换成锌片,LED灯仍然会发光 |
14.苯与乙烯相比较,下列叙述不正确的是( )
| A. | 都能在空气中燃烧 | |
| B. | 都容易发生取代反应 | |
| C. | 苯和乙烯都能在一定条件下发生加成反应 | |
| D. | 苯不能使酸性KMnO4溶液褪色而乙烯能 |
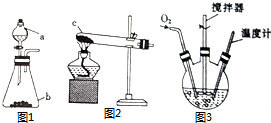 氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题:
氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂.实验室可用废铜屑、浓盐酸、食盐及氧气制取CuCl.已知KMnO4不与稀盐酸反应,回答下列问题: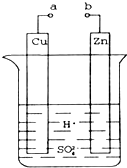 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.