题目内容
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |
考点:阿伏加德罗常数
专题:
分析:A、NO2气体中存在平衡:2NO2?N2O4;
B、用H2O2或Na2O2制氧气,生成1molO2都转移2NA个电子;
C、NH3溶于水后存在平衡:NH3+H2O?NH3?H2O;
D、Cl2与氢氧化钠的反应是歧化反应.
B、用H2O2或Na2O2制氧气,生成1molO2都转移2NA个电子;
C、NH3溶于水后存在平衡:NH3+H2O?NH3?H2O;
D、Cl2与氢氧化钠的反应是歧化反应.
解答:
解:A、NO2气体中存在平衡:2NO2?N2O4,故得到的NO2分子个数少于NA个,故A错误;
B、用H2O2或Na2O2制氧气时,氧元素的化合价是从-1价变为0价,故当生成1molO2时转移2NA个电子,故B错误;
C、NH3溶于水后存在平衡:NH3+H2O?NH3?H2O,故溶液中含有氨气分子少于NA,故C错误;
D、7.1g氯气的物质的量n=
=
=0.1mol,Cl2与氢氧化钠的反应是歧化反应:Cl2+2NaOH=NaCl+NaClO+H2O,此反应中1molCl2转移1mol电子,故0.1mol氯气转移0.1mol电子,个数为0.1NA个,故D正确.
故选D.
B、用H2O2或Na2O2制氧气时,氧元素的化合价是从-1价变为0价,故当生成1molO2时转移2NA个电子,故B错误;
C、NH3溶于水后存在平衡:NH3+H2O?NH3?H2O,故溶液中含有氨气分子少于NA,故C错误;
D、7.1g氯气的物质的量n=
| m |
| M |
| 7.1g |
| 71g/mol |
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列有关说法中,正确的是( )
| A、分馏、干馏、裂化都是化学变化 |
| B、聚乙烯、聚氯乙烯、纤维素都是合成高分子 |
| C、硫酸铜、醋酸、铁都是电解质 |
| D、盐酸、漂白粉、铝热剂都是混合物 |
下列变化不能用勒夏特列原理解释的是( )
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
| A、利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| B、该过程破坏了ZnS的溶解平衡 |
| C、白色沉淀为ZnS,而黑色沉淀为CuS |
| D、上述现象说明ZnS的Ksp小于CuS的Ksp |
检验试样中某离子的操作及结论合理的是( )
| A、先加BaCl2溶液有白色沉淀,再加稀HNO3溶液不溶解,则试样中一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则试样中一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则试样中一定有钾元素、没有钠元素 |
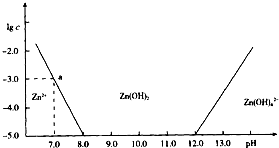 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.