题目内容
检验试样中某离子的操作及结论合理的是( )
| A、先加BaCl2溶液有白色沉淀,再加稀HNO3溶液不溶解,则试样中一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则试样中一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则试样中一定有钾元素、没有钠元素 |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:A.BaCl2溶液中含有钡离子和氯离子,钡离子能形成硫酸钡沉淀,氯离子能形成氯化银沉淀,二者都是不溶于稀HNO3的白色沉淀,白色沉淀可能为氯化银或硫酸钡;
B.能够使澄清石灰水变浑浊的气体有二氧化硫和二氧化碳,所以溶液中可能含有亚硫酸根离子、碳酸氢根离子等;
C.碱性气体是能使湿润红色石蕊试纸变蓝的气体;
D.钾的焰色反应的观察需要透过蓝色钴玻璃滤去黄光,避免钠的焰色对钾的焰色的干扰.
B.能够使澄清石灰水变浑浊的气体有二氧化硫和二氧化碳,所以溶液中可能含有亚硫酸根离子、碳酸氢根离子等;
C.碱性气体是能使湿润红色石蕊试纸变蓝的气体;
D.钾的焰色反应的观察需要透过蓝色钴玻璃滤去黄光,避免钠的焰色对钾的焰色的干扰.
解答:
解:A.向某溶液中加入BaCl2溶液,生成不溶于稀HNO3的白色沉淀,白色沉淀可能是硫酸钡或氯化银,
如Na2SO4+BaCl2=BaSO4↓+2NaCl;也可能为BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓,试样中可能含硫酸根离子也可能含银离子,故A错误;
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体可能为二氧化碳、二氧化硫,溶液中可能存在亚硫酸根离子、亚硫酸氢根离子、碳酸氢根离子,所以该溶液中不一定存在大量CO32-,故B错误;
C.加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,说明原溶液含有NH4+,故C正确;
D.钾的焰色反应的观察需要透过蓝色钴玻璃滤去黄光,避免钠的焰色对钾的焰色的干扰,故试样中可能含钠离子,故D错误;
故选C.
如Na2SO4+BaCl2=BaSO4↓+2NaCl;也可能为BaCl2+2AgNO3=Ba(NO3)2+2AgCl↓,试样中可能含硫酸根离子也可能含银离子,故A错误;
B.某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该气体可能为二氧化碳、二氧化硫,溶液中可能存在亚硫酸根离子、亚硫酸氢根离子、碳酸氢根离子,所以该溶液中不一定存在大量CO32-,故B错误;
C.加入NaOH并加热能产生使湿润红色石蕊试纸变蓝的气体,说明原溶液含有NH4+,故C正确;
D.钾的焰色反应的观察需要透过蓝色钴玻璃滤去黄光,避免钠的焰色对钾的焰色的干扰,故试样中可能含钠离子,故D错误;
故选C.
点评:本题主要考查化学实验方案的评价,把握物质的性质及离子的检验为解答的关键,注意离子检验中应排除干扰,选项B为解答的易错点,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ?mlo-1-1411.0kJ?mlo-1和-1366.8kJ?mlo-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A、-44.2kJ?mol-1 |
| B、+44.2kJ?mol-1 |
| C、-330kJ?mol-1 |
| D、+330kJ?mol-1 |
在m A(g)+n B(g)?p C(g)+q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3mol?L-1,B增加1mol?L-1,C减少2mol?L-1,此时若给体系加压,平衡不移动,则m:n:p:q为( )
| A、2:3:2:3 |
| B、2:2:3:3 |
| C、3:1:2:2 |
| D、3:1:2:3 |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
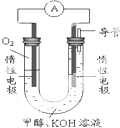 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.