题目内容
已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)H2(g)+
O2(g)═H2O(l)△H3=-285.8kJ?mol-1
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H= .
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ?mol-1
(3)H2(g)+
| 1 |
| 2 |
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:利用已知反应,据盖斯定律解答.
解答:
解:已知(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ?mol-1
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
据盖斯定律,(2)×2+(3)×2-(1)得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488KJ/mol,
故答案为:-488.3 kJ?mol-1.
(2)C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
(3)H2(g)+
| 1 |
| 2 |
据盖斯定律,(2)×2+(3)×2-(1)得:
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=-488KJ/mol,
故答案为:-488.3 kJ?mol-1.
点评:本题考查了反应热、盖斯定律的应用等,注意平时的知识积累.

练习册系列答案
相关题目
下列对摩尔(mol)的有关说法中错误的是( )
| A、摩尔是一个单位而非物理量 |
| B、摩尔既能用来计量纯净物,又能用来计量混合物 |
| C、1mol任何气体所含气体的分子数目都相等 |
| D、H2的摩尔质量是2g |
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ?mlo-1-1411.0kJ?mlo-1和-1366.8kJ?mlo-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
| A、-44.2kJ?mol-1 |
| B、+44.2kJ?mol-1 |
| C、-330kJ?mol-1 |
| D、+330kJ?mol-1 |
在m A(g)+n B(g)?p C(g)+q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3mol?L-1,B增加1mol?L-1,C减少2mol?L-1,此时若给体系加压,平衡不移动,则m:n:p:q为( )
| A、2:3:2:3 |
| B、2:2:3:3 |
| C、3:1:2:2 |
| D、3:1:2:3 |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |
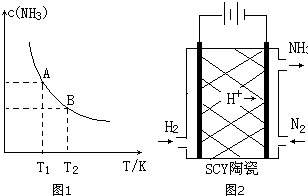 (1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.