题目内容
将23g钠投入到178g水中(足量),充分反应后所得溶液的密度为2.5g?cm-3.计算:
(1)生成H2的体积(标准状况下).
(2)所得溶液中溶质的物质的量浓度为多少?
(1)生成H2的体积(标准状况下).
(2)所得溶液中溶质的物质的量浓度为多少?
考点:化学方程式的有关计算
专题:计算题
分析:根据n=
计算23g Na的物质的量,根据2Na+2H2O=2NaOH+H2↑,计算生成氢气、NaOH的物质的量,根据V=nVm计算氢气的体积;根据m=nM计算氢气的质量,溶液质量=m(Na)+m(水)-m(氢气),再根据V=
计算溶液的体积,根据c=
计算所得溶液物质的量浓度.
| m |
| M |
| m |
| ρ |
| n |
| V |
解答:
解:23g Na的物质的量=
=1mol,
2 Na+2 H2O=2 NaOH+H2↑
2 2 1
1mol n(NaOH) n(H2)
n(NaOH)=1mol
n(H2)=0.5mol
(1)标况下生成氢气的体积=0.5mol×22.4L/mol=11.2L,
答:标况下生成氢气的体积为11.2L;
(2)生成氢气的质量=0.5mol×2g/mol=1g,
所得溶液质量=23g+178g-1g=200g,
所得溶液的体积=
=80mL,
故所得溶液的物质的量浓度=
=12.5mol/L,
答:所得溶液的物质的量浓度为12.5mol/L.
| 23g |
| 23g/mol |
2 Na+2 H2O=2 NaOH+H2↑
2 2 1
1mol n(NaOH) n(H2)
n(NaOH)=1mol
n(H2)=0.5mol
(1)标况下生成氢气的体积=0.5mol×22.4L/mol=11.2L,
答:标况下生成氢气的体积为11.2L;
(2)生成氢气的质量=0.5mol×2g/mol=1g,
所得溶液质量=23g+178g-1g=200g,
所得溶液的体积=
| 200g |
| 2.5g/mL |
故所得溶液的物质的量浓度=
| 1mol |
| 0.08L |
答:所得溶液的物质的量浓度为12.5mol/L.
点评:本题考查化学方程式的有关计算,为高频考点,侧重于学生的分析与计算能力的考查,难度中等,(2)中计算溶液的体积是关键.

练习册系列答案
相关题目
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |
一个原电池反应为:Zn+Cu2+═Zn2++Cu,该原电池的电极及电解质溶液可能是( )
| 正极 | 负极 | 电解质溶液 | |
| A | Zn | Cu | ZnCl2溶液 |
| B | Cu | Zn | 稀H2SO4 |
| C | Cu | Zn | CuSO4溶液 |
| D | 石墨 | Zn | CuSO4溶液 |
| A、A | B、B | C、C | D、D |
实验中的下列操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,又把过量的试剂倒入试剂瓶中 |
| B、Ba(NO3)2 溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后应冷却至室温再转移到容量瓶中 |

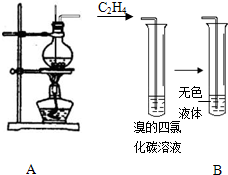 某学习小组用如图所示装置进行验证乙醇和浓硫酸混合加热后是否有乙烯生成的实验.
某学习小组用如图所示装置进行验证乙醇和浓硫酸混合加热后是否有乙烯生成的实验.