题目内容
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是( )
| A、利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| B、该过程破坏了ZnS的溶解平衡 |
| C、白色沉淀为ZnS,而黑色沉淀为CuS |
| D、上述现象说明ZnS的Ksp小于CuS的Ksp |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、上述实验的原理:溶解度大的沉淀可以转化为溶解度更小的另一种沉淀;
B、根据沉淀转化的本质是平衡的移动;
C、首先生成的白色沉淀是ZnS,但是仍然有很小溶解,S2-离子接着和Cu2+反应生成CuS黑色沉淀;
D、根据白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,同类型的沉淀,溶解度越小,Ksp越小.
B、根据沉淀转化的本质是平衡的移动;
C、首先生成的白色沉淀是ZnS,但是仍然有很小溶解,S2-离子接着和Cu2+反应生成CuS黑色沉淀;
D、根据白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,同类型的沉淀,溶解度越小,Ksp越小.
解答:
解:A、利用该原理可实现一种沉淀转化为更难溶的另一种沉淀,故A正确;
B、沉淀转化的本质是平衡的移动,所以上述过程破坏了ZnS的溶解平衡,故B正确;
C、首先生成的白色沉淀是ZnS,但是仍然有很小溶解,S2-离子接着和Cu2+反应生成CuS黑色沉淀,故C正确;
D、白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,即CuS的Ksp小于ZnS的Ksp,故D错误;
故选D.
B、沉淀转化的本质是平衡的移动,所以上述过程破坏了ZnS的溶解平衡,故B正确;
C、首先生成的白色沉淀是ZnS,但是仍然有很小溶解,S2-离子接着和Cu2+反应生成CuS黑色沉淀,故C正确;
D、白色沉淀ZnS转化成CuS黑色沉淀,说明CuS溶解度小于ZnS,即CuS的Ksp小于ZnS的Ksp,故D错误;
故选D.
点评:本题主要考查的是沉淀转化的实质,沉淀现象是分析判断的依据,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关物质分类正确的是( )
| A、液氯、冰水混合均为纯净物 |
| B、NO2、CO、CO2均为酸性氧化物 |
C、 与 与 互为同系物 互为同系物 |
| D、淀粉、纤维素和油脂都属于天然高分子化合物 |
在m A(g)+n B(g)?p C(g)+q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3mol?L-1,B增加1mol?L-1,C减少2mol?L-1,此时若给体系加压,平衡不移动,则m:n:p:q为( )
| A、2:3:2:3 |
| B、2:2:3:3 |
| C、3:1:2:2 |
| D、3:1:2:3 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、标准状况下,22.4LCCl4含有NA个分子 |
| B、0.1molAlCl3完全转化为胶体,生成胶体粒子的数目为0.l NA个 |
| C、常温常压下46gNO2和N2O4的混合气体含有3NA个原子 |
| D、0.1molCl2与足量冷的NaOH溶液反应,转移电子数为0.2 NA |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |
在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察到白色沉淀逐渐转变为黄色沉淀.由这个实验可以说明( )
| A、I-的还原性比Cl-的强 |
| B、Cl-的半径比I-的小 |
| C、AgI的溶解度比AgCl的大 |
| D、实验过程中,平衡AgCl(s)?Ag+(aq)+Cl-(aq)不断向右移动 |
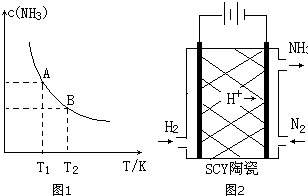 (1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
