题目内容
下列变化不能用勒夏特列原理解释的是( )
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
考点:用盖斯定律进行有关反应热的计算
专题:化学平衡专题
分析:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答:
解:A.工业合成氨的反应,往往需要使用催化剂,可加快化学反应速率,对化学平衡无影响,不能用勒夏特列原理解释,故A选;
B.工业生产硫酸的过程中使用过量的氧气,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故B不选;
C.Fe(SCN)3溶液中加入少量固体KSCN后,增大了SCN-浓度,化学平衡向生成Fe(SCN)3的方向移动,能用勒夏特列原理解释,故C不选;
D.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,可用勒夏特列原理解释,故D不选.
故选A.
B.工业生产硫酸的过程中使用过量的氧气,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故B不选;
C.Fe(SCN)3溶液中加入少量固体KSCN后,增大了SCN-浓度,化学平衡向生成Fe(SCN)3的方向移动,能用勒夏特列原理解释,故C不选;
D.氯气和水反应生成盐酸和次氯酸,该反应存在溶解平衡,饱和食盐水中含有氯化钠电离出的氯离子,饱和食盐水抑制了氯气的溶解,所以实验室可用排饱和食盐水的方法收集氯气,可用勒夏特列原理解释,故D不选.
故选A.
点评:本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、葡萄糖的结构简式:C6H12O6 | ||
| B、NaHCO3的电离:NaHCO3═Na++H++CO32- | ||
C、质子数为53、中子数为78的碘原子:
| ||
D、CO2的电子式: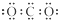 |
在m A(g)+n B(g)?p C(g)+q D(g)的反应中,(m、n、p、q为各物质的化学计量数),经5min达到平衡,测得:A增加3mol?L-1,B增加1mol?L-1,C减少2mol?L-1,此时若给体系加压,平衡不移动,则m:n:p:q为( )
| A、2:3:2:3 |
| B、2:2:3:3 |
| C、3:1:2:2 |
| D、3:1:2:3 |
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、22.4L(标况下)NO与0.5molO2混合充分反应,最后得到NA个NO2分子 |
| B、任何反应中,生成1molO2都转移4NA个电子 |
| C、100g17%的氨水,溶液中含有氨气分子NA |
| D、7.1gCl2与足量氢氧化钠溶液反应转移电子数为0.1NA |


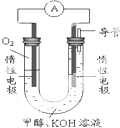 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.