题目内容
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
| A、用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 |
| B、配制稀盐酸定容时,俯视容量瓶刻度线 |
| C、滴定前尖嘴处无气泡,滴定终点时有气泡 |
| D、滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下 |
考点:中和滴定
专题:
分析:A.量筒中的蒸馏水稀释了浓盐酸,导致浓盐酸浓度减小;
B.定容时俯视容量瓶刻度线,导致加入的蒸馏水体积偏小;
C.滴定管下端尖嘴处悬挂有一滴液滴,导致消耗的标准液的体积偏大;
D.蒸馏水不影响待测液中溶质的物质的量,对滴定结果没有影响.
B.定容时俯视容量瓶刻度线,导致加入的蒸馏水体积偏小;
C.滴定管下端尖嘴处悬挂有一滴液滴,导致消耗的标准液的体积偏大;
D.蒸馏水不影响待测液中溶质的物质的量,对滴定结果没有影响.
解答:
解:A.用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸,会导致浓盐酸被稀释,导致标准液盐酸浓度减小,造成V(标准)偏大,根据c(待测)=
分析,测定结果偏大,故A正确;
B.配制稀盐酸定容时,俯视容量瓶刻度线,容量瓶中加入的蒸馏水体积偏小,导致标准液盐酸浓度偏大,造成V(标准)偏小,根据c(待测)=
分析,测定结果偏低,故B错误;
C.滴定前尖嘴处无气泡,滴定终点时有气泡,造成V(标准)偏小,根据c(待测)=
分析,测定结果偏低,故C错误;
D.滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下,对待测液物质的量没有影响,对V(标准)无影响,根据c(待测)=
分析,测定结果无影响,故D错误;
故选A.
| c(标注)×V(标准) |
| V(待测) |
B.配制稀盐酸定容时,俯视容量瓶刻度线,容量瓶中加入的蒸馏水体积偏小,导致标准液盐酸浓度偏大,造成V(标准)偏小,根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
C.滴定前尖嘴处无气泡,滴定终点时有气泡,造成V(标准)偏小,根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
D.滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下,对待测液物质的量没有影响,对V(标准)无影响,根据c(待测)=
| c(标注)×V(标准) |
| V(待测) |
故选A.
点评:本题考查了中和滴定中的误差分析,根据c(待测)=
即可完成,培养了学生的灵活应用所学知识解决实际问题的能力.
| c(标注)×V(标准) |
| V(待测) |

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
CO2+NH3+H20+A═NaHCO3↓+NH4Cl是侯氏制碱法的重要反应,反应中物质A的化学式为( )
| A、Na2O |
| B、NaCl |
| C、NaOH |
| D、Na2CO3 |
设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |
下列离子方程式中正确的是( )
| A、氯化亚铁溶液与过氧化钠2:1反应:6Fe2++3 Na2O2+6 H2O=4Fe(OH)3↓+6 Na++2Fe3+ |
| B、向氧化铁中加入氢碘酸发生反应:Fe2O3+6H++6 I -=2Fe2++3I2+3H2O |
| C、双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+O2↑+2 H2O |
| D、向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O |
反应H2(g)+CO2(g)?H2O(g)+CO(g),某温度下该反应的平衡常数K=
.该温度下在甲、乙、丙三个恒容密闭容器中,只投入H2(g)和CO2(g),其起始浓度如下表所示.下列判断正确的是( )
| 9 |
| 4 |
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
| A、反应开始时,丙中的反应速率最快,乙中的反应速率最慢 |
| B、平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L |
| C、平衡时,甲中和丙中H2的转化率均是60% |
| D、平衡时,乙中CO2的转化率大于60% |
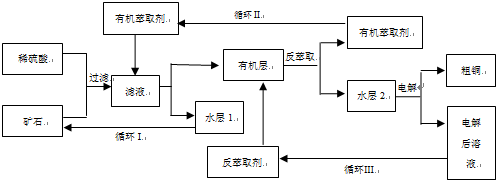
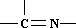 三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是
三种基团,无环状结构,若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是