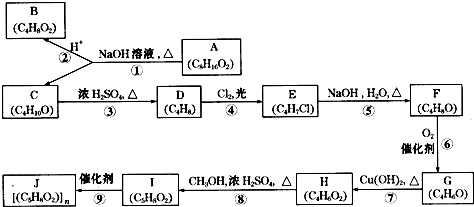
题目内容
化学兴趣小组的同学将Na2SO3在隔绝空气并经600℃以上的强热至恒重,然后对加热后固体进行元素定性定量分析,确定固体元素组成与Na2SO3无异;但把加热后固体溶于水,得到的溶液pH值比Na2SO3溶液的pH高.
(1)Na2SO3溶液呈 性(填“酸”或“碱”),其原理是(以相关的离子方程式表示) .
(2)甲乙两同学都以为Na2SO3在强热下发生了分解反应(自身氧化还原反应且Na2SO3没有剩余),并对强热后留下的物质作了如下猜测:猜测1: ;猜测2: .
(3)甲设计实验方案证明上面的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol?L-1 HCl、0.1mol?L-1BaCl2、0.1mol?L-1KCl、蒸馏水)
(4)乙同学根据甲的实验步骤对生成物进行了定量检测,结果步骤2收集的气体标况下体积为0.224L,步骤3得到的干燥固体质量为7.52.你分析造成这种结果的可能原因是 .
(1)Na2SO3溶液呈
(2)甲乙两同学都以为Na2SO3在强热下发生了分解反应(自身氧化还原反应且Na2SO3没有剩余),并对强热后留下的物质作了如下猜测:猜测1:
(3)甲设计实验方案证明上面的假设,请按下表格式完成相关内容.(限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、试管夹;6mol?L-1 HCl、0.1mol?L-1BaCl2、0.1mol?L-1KCl、蒸馏水)
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解则没有S生成 |
| 步骤2:取少许液体加HCl | |
| 步骤3 取少许液体加HCl和BaCl2 |
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)Na2SO3为强碱弱酸盐,SO32-水解呈碱性;
(2)Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S;
(3)根据Na2SO4、Na2S、S的性质结合操作步骤回答现象和结论;
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠,反应的方程式为4Na2SO3=3Na2SO4+Na2S,产生0.224L气体为硫化氢,物质的量为:
=0.01mol,则硫化钠的物质的量为0.01mol,根据方程式计算硫酸钠的物质的量,进而计算出生成硫酸钡的质量和步骤3得到的干燥固体质量相比较,分析原因.
(2)Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S;
(3)根据Na2SO4、Na2S、S的性质结合操作步骤回答现象和结论;
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠,反应的方程式为4Na2SO3=3Na2SO4+Na2S,产生0.224L气体为硫化氢,物质的量为:
| 0.224L |
| 22.4L/mol |
解答:
解:(1)Na2SO3为强碱弱酸盐,SO32-水解呈碱性,水解的离子方程式为SO32-+H2O?HSO3-+OH-,
故答案为:碱;SO32-+H2O?HSO3-+OH-;
(2)Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S,
则有三种可能:生成Na2SO4和S; 生成Na2SO4和Na2S; 生成Na2SO4、S和Na2S (任意答出两项即可);
故答案为:生成Na2SO4和S; 生成Na2SO4和Na2S; 生成Na2SO4、S和Na2S;
(3)加入一定量的蒸馏水全部溶解,说明无S生成;若滴加盐酸有特殊气味的气体放出,在酸性条件下发生:S2-+2H+=H2S↑,说明有硫化钠生成;
取少许液体加HCl和BaCl2,若有白色沉淀生成,则说明固体中含有Na2SO4.
故答案为:
(4)由题意可知亚硫酸钠分解生成硫酸钠和硫化钠,反应的方程式为4Na2SO3=3Na2SO4+Na2S,产生0.224L气体为硫化氢,物质的量为:
=0.01mol,则硫化钠的物质的量为0.01mol,硫酸钠的物质的量为0.03mol,和氯化钡反应生成硫酸钡的质量为:0.03mol×233g/mol=6.99g,小于步骤3得到的干燥固体质量7.52,说明有部分亚硫酸钠可能被空气中氧气氧化成硫酸钠,故答案为:可能是Na2SO3部分被装置中的空气中的O2氧化.
故答案为:碱;SO32-+H2O?HSO3-+OH-;
(2)Na2SO3在强热下发生了自身氧化还原反应,化合价升高可生成Na2SO4,说明化合价降低生成可能生成S或Na2S,
则有三种可能:生成Na2SO4和S; 生成Na2SO4和Na2S; 生成Na2SO4、S和Na2S (任意答出两项即可);
故答案为:生成Na2SO4和S; 生成Na2SO4和Na2S; 生成Na2SO4、S和Na2S;
(3)加入一定量的蒸馏水全部溶解,说明无S生成;若滴加盐酸有特殊气味的气体放出,在酸性条件下发生:S2-+2H+=H2S↑,说明有硫化钠生成;
取少许液体加HCl和BaCl2,若有白色沉淀生成,则说明固体中含有Na2SO4.
故答案为:
| 实验步骤 | 预期现象及结论 |
| 步骤1:取少量固体分别于试管中,加入一定量的蒸馏水溶解 | 固体全部溶解则没有S生成 |
| 步骤2:取少许液体加HCl | 如有刺激性气味气体产生则有Na2S生成 |
| 步骤3 取少许液体加HCl和BaCl2 | 如有白色沉淀生成,则说明固体中含有Na2SO4,结合步骤1,则假设1不成立,结合步骤2,则假设2成立. |
| 0.224L |
| 22.4L/mol |
点评:本题考查含硫物质的性质及综合应用,题目难度中等,本题注意物质的组成判断的几个关键点①得到的溶液pH值比Na2SO3溶液的pH高;②自身氧化还原反应且Na2SO3没有剩余.

练习册系列答案
相关题目
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
| A、用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 |
| B、配制稀盐酸定容时,俯视容量瓶刻度线 |
| C、滴定前尖嘴处无气泡,滴定终点时有气泡 |
| D、滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下 |
将钠、铝混合物W1g投入一定量水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向反应后的溶液中逐滴加入浓度为a mol?L-1的盐酸,在此过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液蒸干、灼烧得固体W2g.下列关系式错误的是( )
| A、35.5aV2=W2-W1 | ||
| B、23n(Na)+27n(Al)=W1 | ||
C、n(Na)+3n(Al)=
| ||
D、aV2=
|
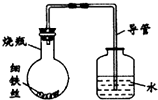 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.