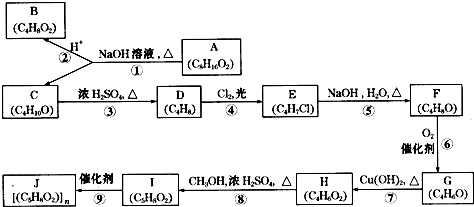
题目内容
设NA为阿伏加德罗常数,下列叙述不正确的是( )
| A、1molNH4+中含质子数为11NA |
| B、1molOH-中含电子数为10NA |
| C、1molNa+中含电子数为10NA |
| D、1molF-含有的质子数与电子数之和为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、铵根离子中含有11个质子;
B、离子是10电子微粒;
C、钠离子是10电子微粒;
D、氟离子含有质子数为9,电子数为10.
B、离子是10电子微粒;
C、钠离子是10电子微粒;
D、氟离子含有质子数为9,电子数为10.
解答:
解:A、铵根离子中含有11个质子,1molNH4+中含质子数为11NA,故A正确;
B、离子是10电子微粒,1molOH-中含电子数为10NA,故B正确;
C、钠离子是10电子微粒,1molNa+中含电子数为10NA,故C正确;
D、氟离子含有质子数为9,电子数为10,1molF-含有的质子数与电子数之和为19NA,故D错误;
故选D.
B、离子是10电子微粒,1molOH-中含电子数为10NA,故B正确;
C、钠离子是10电子微粒,1molNa+中含电子数为10NA,故C正确;
D、氟离子含有质子数为9,电子数为10,1molF-含有的质子数与电子数之和为19NA,故D错误;
故选D.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是微粒结构的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
若50滴水正好是mmL,则1滴水所含的分子数是( )
| A、m×50×18×6.02×1023 | ||
B、
| ||
C、
| ||
D、
|
关于O2与O3气体,下列比值一定为2:3的是( )
| A、若温度和压强相同,两种气体的密度之比 |
| B、当两种气体所占体积相同,所含氧原子数之比 |
| C、若两种气体原子数相同,两种气体的质子数之比 |
| D、若两种气体的质量相同,两种气体的分子数之比 |
使用酸碱中和滴定的方法,用0.01mol/L盐酸滴定锥形瓶中未知浓度的NaOH溶液,下列操作能够使测定结果偏高的是( )
| A、用量筒量取浓盐酸配制0.1mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 |
| B、配制稀盐酸定容时,俯视容量瓶刻度线 |
| C、滴定前尖嘴处无气泡,滴定终点时有气泡 |
| D、滴定过程中用少量蒸馏水将锥形瓶内壁粘附的盐酸冲下 |
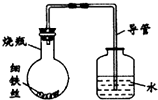 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.