题目内容
1. 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g)?N2(g)+2CO2(g);△H<0,该反应的化学平衡常数表达式:K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$.
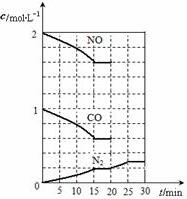
(2)若在一定温度下,将2molNO、1molCO充入1L 固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将不移动(填“向左”、“向右”或“不”).
(3)20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是②(填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(4)在研究氮的氧化物的转化时,某小组查阅到以下数据:25℃、1.01×105Pa时,2NO2(g)?N2O4(g)△H<0的平衡常数 K=12.5,则该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时,若 c (NO2)═0.04mol?L-1,c (N2O4)═0.02mol/L;改变上述体系的某个条件,达到新的平衡后测得混合气体中 c (NO2)=0.05 mol?L-1,c (N2O4)=0.008 mol?L-1,则改变的条件为升高温度.
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)计算平衡时二氧化碳的浓度,将各组分的平衡浓度代入平衡常数表达式K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$计算平衡常数,再计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行;
(3)20min时,改变反应条件瞬间N2浓度不变,而后N2浓度增大,结合外界条件对平衡影响分析解答;
(4)根据平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=12.5计算c c(N2O4);
平衡时平衡常数K=$\frac{0.008}{0.0{5}^{2}}$=3.2<12.5,改变温度使平衡逆向移动,正反应为放热反应,应是升高温度.
解答 解:(1)2NO(g)+2CO(g)?N2(g)+2CO2(g)的平衡常数表达式K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$,故答案为:$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$;
(2)由方程式可知,平衡时二氧化碳的浓度为0.2mol/L×2=0.4mol/L,平衡常数K=$\frac{c({N}_{2})×{c}^{2}(C{O}_{2})}{{c}^{2}(NO)×{c}^{2}(CO)}$=$\frac{0.2×0.{4}^{2}}{1.{6}^{2}×0.{6}^{2}}$=$\frac{5}{144}$,若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,则浓度商=$\frac{(0.2+0.6)×0.{4}^{2}}{1.{6}^{2}×(0.6+0.6)^{2}}$=$\frac{5}{144}$,等于平衡常数,故平衡不移动,
故答案为:不;
(3)20min时,改变反应条件瞬间N2浓度不变,而后N2浓度增大:
①加入催化剂,平衡不移动,氮气浓度不变,故错误;
②降低温度,瞬间氮气浓度不变,正反应为放热反应,平衡向正反应移动,氮气浓度增大,故正确;
③缩小容器体积,瞬间氮气浓度增大,平衡向向正反应方向移动,氮气浓度继续增大,故错误;
④增加CO2的量,瞬间氮气浓度不变,平衡向逆反应移动,氮气浓度减小,故错误,
故选:②;
(4)若平衡时,若c(NO2)═0.04mol?L-1,根据平衡常数K=$\frac{c({N}_{2}{O}_{4})}{{c}^{2}(N{O}_{2})}$=12.5,可知c c(N2O4)=12.5×0.042 mol/L=0.02mol/L;
平衡时平衡常数K=$\frac{0.008}{0.0{5}^{2}}$=3.2<12.5,改变温度使平衡逆向移动,正反应为放热反应,应是升高温度,
故答案为:0.02mol/L;升高温度.
点评 本题考查化学平衡常数及应用、化学平衡影响因素等,需要学生具备扎实的基础与灵活运用能力,化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

| A. | 氮气化学性质不活泼,可用作食品防腐剂 | |
| B. | 硅胶无毒、无味、无腐蚀性,可用作食品干燥剂 | |
| C. | SiO2、Al2O3、MgO都有很高的熔点,可以制耐火材料 | |
| D. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
| A. | 加热 | B. | 加入催化剂 | C. | 减小压强 | D. | 增加C的物质的量 |
| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |
| A. | 放电时,Fe参与负极反应,NiO2参与正极反应 | |
| B. | 充电时,阴极上的电极反应式为:Fe(OH)2+2e-═Fe+2OH- | |
| C. | 蓄电池的电极必须浸入某种碱性电解质溶液中 | |
| D. | 放电时,电解质溶液中的阴离子向正极方向移动 |
| A. | 在蔗糖水解(用稀H2SO4作催化剂)后的溶液中直接加少量新制Cu(OH)2加热有砖红色沉淀产生 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在苯中滴入浓硝酸制硝基苯 | |
| D. | 将铜丝在酒精灯加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
| A. | 化学反应的平衡常数越大,反应进行的速率越快 | |
| B. | 加热、蒸干NaAlO2溶液和AlCl3溶液,并灼烧都得到Al2O3 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| D. | 0.1mol•L-1CH3COONa溶液中加入少量固体NaOH,碱性增强,平衡向水解方向移动 |
 .
.