题目内容
12.在一定温度下的密闭容器中,已达平衡状态的下列反应:A(s)+2B(g)?C(g)+D(g),其它条件不变时,改变下列条件,平衡会发生移动的是( )| A. | 加热 | B. | 加入催化剂 | C. | 减小压强 | D. | 增加C的物质的量 |
分析 A、反应过程中一定伴随能量变化,反应过程中不是吸热就是放热反应,改变温度平衡发生移动;
B、催化剂改变反应速率不改变化学平衡;
C、反应前后气体体积不变,改变压强不影响平衡移动;
D、增加生成物浓度平衡逆向进行;
解答 解:A、反应过程中一定伴随能量变化,反应过程中不是吸热就是放热反应,改变温度平衡发生移动,故A符合;
B、催化剂改变反应速率不改变化学平衡,平衡不发生移动,故B不符合;
C、A为固体,反应前后气体体积不变,改变压强不影响平衡移动,故C不符合;
D、增加C的物质的量,增加生成物浓度平衡逆向进行,故D符合;
故选AD.
点评 本题考查了化学平衡影响因素分析判断,平衡移动原理是解题关键,题目较简单.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
2.一份100ml 0.2mol/L的NaCl溶液,下列哪个选项与该溶液中的Cl-浓度相同( )
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
7.某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol•L-1,含有硝酸的浓度为1mol•L-1,现向其中加入0.96g 铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
| A. | 224 mL | B. | 168 mL | C. | 112 mL | D. | 448 mL |
17.下列有关叙述正确的是( )
| A. | 在一定条件下,反应CO(g)+2H2(g)?CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 | |
| B. | 常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol/L | |
| C. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| D. | 已知某温度下:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀 |
4.既能跟盐酸反应,又能跟氢氧化钠溶液反应的氢氧化物是( )
| A. | Al2O3 | B. | MgO | C. | NaHCO3 | D. | Al(OH)3 |
2.下列说法正确的是( )
| A. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| B. | 室温下,向pH=3的醋酸溶液加水稀释后,溶液中所有离子浓度均减小 | |
| C. | 向含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-) |
 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: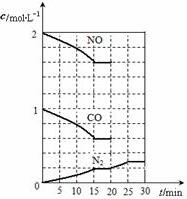 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.