题目内容
9.下列叙述符合平衡移动原理的是( )| A. | 向FeCl3+3KSCN?Fe(SCN)3+3KCl平衡体系中,加入KCl固体,溶液颜色加深 | |
| B. | 对2NO2?N2O4的平衡体系增大压强,平衡后气体颜色变浅 | |
| C. | 对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,容器内气体颜色变深 | |
| D. | 向滴有石蕊的醋酸溶液中通入HCl气体,溶液颜色加深 |
分析 勒夏特列原理主要内容为:在一个已经达到平衡的反应中,如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动,能用勒夏特列原理解释,首先必须存在可逆过程,以此解答该题.
解答 解:A、向体系中加入氯化钾固体时,氯化钾浓度增大,但体系颜色不变,氯化钾不影响平衡,不符合平衡移动原理,故A错误;
B、对2NO2?N2O4的平衡体系增大压强,会正向移动,二氧化氮浓度减小,平衡后气体颜色变浅,故B正确;
C、对H2(g)+I2(g)?2HI(g)的平衡体系增大压强,各组分浓度增加,容器内气体颜色变深,但是平衡不会发生移动,故C错误;
D、向滴有石蕊的醋酸溶液中通入HCl气体,盐酸完全电离出氢离子,氢离子浓度增大,所以酸性增强,溶液颜色加深,不符合平衡移动原理,故D错误;
故选B.
点评 本题考查了勒夏特列原理的使用条件,注意使用勒夏特列原理的前提必须是可逆反应,题目难度不大.

练习册系列答案
相关题目
19.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘积为1×10-10,则该溶液可能是( )
①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
17.下列有关叙述正确的是( )
| A. | 在一定条件下,反应CO(g)+2H2(g)?CH3OH(g)在一密闭容器中达到平衡,充入适量氢气,增大容器的体积,维持H2的浓度和容器的温度不变,原平衡相比较达新平衡时CO的转化率不变 | |
| B. | 常温下:pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化),反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol/L | |
| C. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| D. | 已知某温度下:Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12,将0.001mol/L的AgNO3溶液逐滴滴入0.001mol/L的KCl和0.001mol/L K2CrO4溶液,则先产生Ag2CrO4沉淀 |
4.既能跟盐酸反应,又能跟氢氧化钠溶液反应的氢氧化物是( )
| A. | Al2O3 | B. | MgO | C. | NaHCO3 | D. | Al(OH)3 |
18.短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素最外层电子数是其内层电子总数3倍;C元素原子M层电子数是K层电子数的3倍;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是( )
| A. | C>D>B>A | B. | D>B>A>C | C. | A>D>C>B | D. | B>A>C>D |
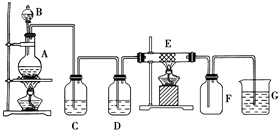 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: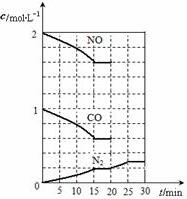 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.