题目内容
11.下列有关物质的性质与应用不相对应的是( )| A. | 氮气化学性质不活泼,可用作食品防腐剂 | |
| B. | 硅胶无毒、无味、无腐蚀性,可用作食品干燥剂 | |
| C. | SiO2、Al2O3、MgO都有很高的熔点,可以制耐火材料 | |
| D. | 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂 |
分析 A.氮气化学性质不活泼;
B.硅胶具有吸水性,无毒;
C.SiO2、Al2O3、MgO熔点较高;
D.二氧化锰无强氧化性.
解答 解:A.氮气化学性质不活泼,所以可用于食品包装袋内防腐,故A正确;
B.硅胶具有吸水性,无毒,则硅胶可用作食品干燥剂,故B正确;
C.SiO2、Al2O3、MgO熔点较高,可做耐火材料,故C正确;
D.二氧化锰用作H2O2分解的氧化剂,与氧化性无关,故D错误.
故选D.
点评 本题考查物质的性质及食品干燥剂,为高频考点,把握物质的性质、化学与生活的关系为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.

练习册系列答案
相关题目
1.下列电离方程式中,正确的是( )
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
2.一份100ml 0.2mol/L的NaCl溶液,下列哪个选项与该溶液中的Cl-浓度相同( )
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
19.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度乘积为1×10-10,则该溶液可能是( )
①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
①H2SO4;②CH3COOH;③NH4Cl;④KOH;⑤CH3COONa.
| A. | ①④⑤ | B. | ③ | C. | ①②③ | D. | ③⑤ |
16.设反应C+CO2?2CO△H>0,反应速率为v1;平衡常数为K1;N2+3H2?2NH3 △H<0,反应速率为v2,平衡常数为K2.对于上述反应,当温度升高时,v1、v2、K1、K2的变化情况为( )
| A. | v1、v2、K1、K2同时增大 | B. | v1、v2、K1、K2同时减小 | ||
| C. | v1、v2增大,K1增大,K2减小 | D. | v2减小,v1增大,K1增大,K2减小 |
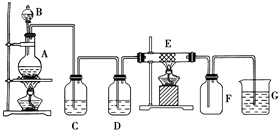 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答: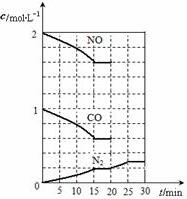 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.