题目内容
12. (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.①若要进行中和滴定实验,还缺少的玻璃仪器是锥形瓶.
②若要用碳酸钠固体配制一定物质的量浓度的碳酸钠溶液,还缺少的玻璃仪器是胶头滴管.
(2)某学生往一支试管中按一定的顺序分别加入下列几种溶液(一种溶液只加一次):
A.KI溶液 B.淀粉溶液 C.NaOH溶液 D.稀H2SO4E.氯水.
发现溶液颜色按如下顺序变化:无色→棕黄色→蓝色→无色→蓝色.
依据溶液颜色的变化,判断加入以上药品的顺序是(填写序号)A→E→B→C→D.
(3)众所周知,氢气燃烧生成水.然而,资料表明,
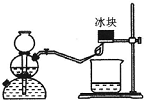
氢气燃烧时除生成水外,还生成另一产物.某同学用如右图所示的实
验装置,验证该产物的存在.实验步骤及现象如下:制 H2、验纯,
将火焰对着冰块.
①在小烧杯内加入用硫酸酸化的稀KI淀粉溶液,将小烧杯放在冰块
下方,观察到烧杯中溶液由无色变成了蓝色.
②在另一个小烧杯内加入用硫酸酸化的稀 KMn04溶液,将小烧杯放在冰块下方,观察到烧杯中溶液变成了无色.请你写出另一产物的结构式:H-O-O-H;
由上述实验中可以归纳出该产物的化学性质有氧化性和还原性.
分析 (1)①中和滴定实验的玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶;
②根据配制一定物质的量浓度的碳酸钠溶液需要的仪器有托盘天平、药匙、烧杯、玻璃棒、一定规格的容量瓶、胶头滴管;
(2)KI溶液和氯水反应生成单质碘,碘溶于水呈棕黄色,碘遇淀粉溶液,溶液变蓝,碘与NaOH溶液反应生成碘化钠、碘酸钠和水,蓝色褪去,碘化钠和碘酸钠在酸性条件下生成单质碘,溶液变蓝;
(3)根据过氧化氢在酸性条件下能氧化KI,生成单质碘,溶液变蓝;根据KMn04溶液在酸性条件下能氧化过氧化氢,溶液褪色;
解答 解:(1)①因中和滴定实验的玻璃仪器有:酸式滴定管、碱式滴定管、锥形瓶,
故答案为:锥形瓶;
②因配制一定物质的量浓度的碳酸钠溶液需要的仪器有托盘天平、药匙、烧杯、玻璃棒、一定规格的容量瓶、胶头滴管,
故答案为:胶头滴管;
(2)KI溶液和氯水反应生成单质碘,碘溶于水呈棕黄色,碘遇淀粉溶液,溶液变蓝,碘与NaOH溶液反应生成碘化钠、碘酸钠和水,蓝色褪去,碘化钠和碘酸钠在酸性条件下生成单质碘,溶液变蓝,故答案为:A→E→B→C→D;
(3)因过氧化氢在酸性条件下能氧化KI,生成单质碘,溶液变蓝,过氧化氢体现了氧化性;因KMn04溶液在酸性条件下能氧化过氧化氢,溶液褪色,过氧化氢体现了还原性,
故答案为:H-O-O-H;氧化性和还原性.
点评 本题主要考查了常见的实验操作以及过氧化氢的性质,难度中等,解题时要抓住题目的信息.

练习册系列答案
相关题目
16.一定温度下,在一密闭容器中加入1molPCl5,发生反应PCl5(g)?PCl3(g)+Cl2 (g)充分反应平衡后,测得PCl5的分解率为a%,此时,再向密闭容器中加入1mol PCl5,充分反应,再次平衡后,下列有关说法正确的是( )
| A. | PCl5的分解率大于a% | |
| B. | PCl5的分解率小于a% | |
| C. | 达到平衡后正逆反应速率比原平衡状态时大 | |
| D. | 达到平衡后正逆反应速率比原平衡状态时小 |
17.一定温度下,将NO2与SO2以体积比为1:2置于密闭容器中发生NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1,测得上述反应平衡时NO2与SO2体积比为1:6,下列说法正确的是( )
| A. | 平衡常数K=$\frac{8}{3}$ | |
| B. | 达到平衡后NO2和SO2的转化率相等 | |
| C. | SO3和NO的体积比保持不变可以证明达到平衡状态 | |
| D. | 每消耗1molSO3的同时生成1molNO2可以证明达到平衡状态 |
1.11P+15CuSO4+24H2O═5Cu3P+6H3PO4+15H2SO4 反应中,1mol Cu2+能氧化 P 的物质 的量是( )
| A. | $\frac{2}{5}$ mol | B. | $\frac{11}{5}$ mol | C. | $\frac{1}{5}$ mol | D. | $\frac{1}{3}$ mol |
2.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
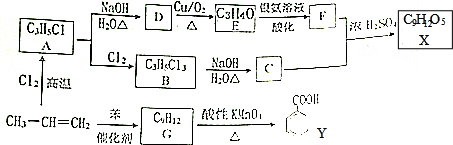
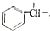 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$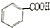
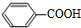 +CH2=CHCH2OH$→_{△}^{浓硫酸}$
+CH2=CHCH2OH$→_{△}^{浓硫酸}$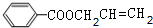 +H2O.
+H2O.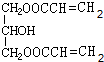 (任写一种即可).对于化合物X,下列说法正确的是AC.
(任写一种即可).对于化合物X,下列说法正确的是AC.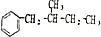 :则Z的同分异构体中,符合
:则Z的同分异构体中,符合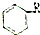 结构且有2个CH3的有3种(不包括Z).
结构且有2个CH3的有3种(不包括Z).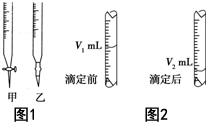 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白: