题目内容
15.现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离.相应的实验过程可用如图表示: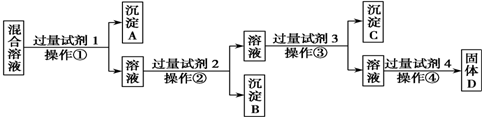
(1)写出上述实验过程中所用试剂或沉淀的化学式:试剂1BaCl2[或Ba(NO3)2]、沉淀BAgCl,试剂4HNO3;
(2)写出生成沉淀C的离子方程式2Ag++CO32-=Ag2CO3↓、Ba2++CO32-=BaCO3↓;
(3)恰当地控制试剂4的加入量的方法是测定溶液pH.
(4)检验试剂1是否过量的方法是取上层澄清液于小试管中,滴加硫酸钠,如生成沉淀,说明过量.
(5)在加入试剂4后,获得固体D的实验操作④是蒸发、冷却、结晶、过滤.(填操作名称).
分析 如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3,以此解答该题.
解答 解:如先加入AgNO3,则会同时生成Ag2SO4和AgCl沉淀,则应先加入过量的BaCl2[或Ba(NO3)2],生成BaSO4沉淀,然后在滤液中加入过量的AgNO3,使Cl-全部转化为AgCl沉淀,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,最后进行蒸发操作可得固体NaNO3.
(1)由以上分析可知试剂1为BaCl2[或Ba(NO3)2],沉淀B为AgCl,试剂4为HNO3,故答案为:BaCl2[或Ba(NO3)2];AgCl;HNO3;
(2)溶液中存在过量的Ag+、Ba2+,在所得滤液中加入过量的Na2CO3,使溶液中的Ag+、Ba2+完全沉淀,反应的离子方程式为2Ag++CO32-=Ag2CO3↓、Ba2++CO32-=BaCO3↓,
故答案为:2Ag++CO32-=Ag2CO3↓、Ba2++CO32-=BaCO3↓;
(3)硝酸的量不可加入太多,最后所得溶液为NaNO3和Na2CO3的混合物,加入稀HNO3,发生:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑,可通过测定溶液pH的方法判断反应是否已经完全.
故答案为:测定溶液pH;
(4)试剂1为BaCl2[或Ba(NO3)2],如过量,则上层澄清液中含有钡离子,可取少量于试管中,滴加硫酸钠,如生成沉淀,说明过量,
故答案为:取上层澄清液于小试管中,滴加硫酸钠,如生成沉淀,说明过量;
(5)从溶液中获得固体,应将溶液进行蒸发,然后冷却结晶、最后过滤可得固体,故答案为:蒸发、冷却、结晶、过滤.
点评 本题考查物质的分离提纯操作,题目难度中等,本题注意Cl-、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 向次氯酸钙溶液中通入少量的二氧化硫:Ca2++3ClO-+SO2+H2O═CaSO4+2HClO+Cl- | |
| B. | 向偏铝酸钠溶液中通入少量的二氧化碳:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 向硅酸钠水溶液中通入少量的二氧化碳:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向次氯酸钠溶液中通入少量的二氧化碳:ClO-+CO2+H2O═HClO+HCO3- |
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
| A. | 甲烷分子的比例模型: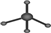 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: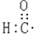 | D. | 甲醛的结构式: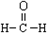 |
①二氧化硫通入到硝酸钡溶液中
②二氧化碳通入到偏铝酸钠溶液中
③二氧化碳通入到氯化钙溶液中
④氨气通入到氯化镁溶液中.
| A. | 只有①②③ | B. | 只有①② | C. | 只有②③ | D. | 只有①②④ |
 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.