题目内容
4.(1)下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:KHCO3HCO3-+H2O?H2CO3+OH-,溶液呈碱性;
K2SO4不发生水解,溶液呈中性;
CuCl2Cu2++2H2O?Cu(OH)2+2H+,溶液呈酸性.
(2)将100mL 0.3mol•L-1的NaHSO4溶液和100mL 0.2mol•L-1的Ba(OH)2溶液充分混合,写出所发生反应的离子方程式:3H++2SO42-+2Ba2++3OH-=2BaSO4↓+3H2O;
若向反应后的溶液中滴加2-3滴酚酞试液,则溶液的颜色变为红色;
(3)25℃时,pH=12.0的KOH溶液中,由水电离出的c(OH-)=1×10-12mol/L;pH=12.0的K2CO3溶液中,由水电离出来的c(OH-)=1×10-2mol/L.
分析 (1)KHCO3为强碱弱酸盐,碳酸氢根离子水解导致溶液呈碱性;K2SO4为强碱强酸盐,不水解,溶液呈中性;CuCl2是强酸弱碱盐,铜离子水解溶液显酸性;
(2)n(NaHSO4)=0.1L×0.3mol/L=0.03mol/L,n[Ba(OH)2]=0.1L×0.2mol/L=0.02mol,Ba2+完全反应,生成硫酸钡、水、NaOH,反应后溶液显碱性,据此进行解答;
(3)碱抑制水电离,含有弱根离子的盐促进水电离,碱溶液中水电离出的氢氧根离子浓度等于溶液中氢离子浓度,K2CO3溶液中水电离出的氢氧根离子浓度为水的离子积常数与氢离子浓度的比.
解答 解:(1)碳酸钾为强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为:HCO3-+H2O?H2CO3+OH-;
K2SO4为强碱强酸盐,钾离子和硫酸根离子都不发生水解,所以K2SO4溶液呈中性;
CuCl2是强酸弱碱盐,铜离子水解后溶液呈酸性,水解离子方程式为:Cu2++2H2O?Cu(OH)2+2H+,
故答案为:HCO3-+H2O?H2CO3+OH-;碱;不发生水解;中;Cu2++2H2O?Cu(OH)2+2H+;酸;
(2)100mL0.3mol•L-1的NaHSO4溶液中含有硫酸氢钠的物质的量为:n(NaHSO4)=0.1L×0.3mol/L=0.03mol/L,
100mL0.2mol•L-1的Ba(OH)2溶液中含有氢氧化钡的物质的量为:n[Ba(OH)2]=0.1L×0.2mol/L=0.02mol,
硫酸根离子过量,则Ba2+完全反应,生成硫酸钡、水、NaOH,反应的离子反应为:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O,
反应后溶液显碱性,滴加2~3滴酚酞试液,则溶液的颜色变为红色,
故答案为:3H++2SO42-+2Ba2++3OH-═2BaSO4↓+3H2O;红色;
(3)碱抑制水电离,含有弱根离子的盐促进水电离,则25℃时pH=12.0的KOH溶液中水电离出的c(OH-)=c(H+)=1×10-12 mol/L,
K2CO3是强碱弱酸盐,碳酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,所以水电离出来的c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$mol/L=1×10-2 mol/L,
故答案为:1×10-12;1×10-2.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、溶液pH的计算、离子方程式书写等知识,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理及其应用方法.

 名校课堂系列答案
名校课堂系列答案| A. | 甲烷分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 醛基的电子式: | D. | 甲醛的结构式: |
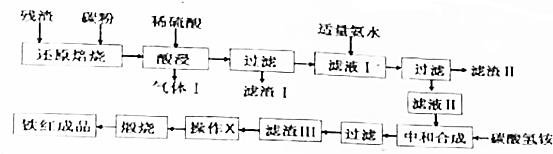
查阅资料:
Ⅰ部分金属离子发生沉淀的pH:
| 金属离子 | Fe3+ | Al3+ | Fe2+ |
| 开始沉淀的pH | 2.2 | 3.1 | 7.5 |
| 完全沉淀的pH | 3.5 | 5.4 | 9.5 |
请根据以上工艺流程及提供的信息,回答下列问题:
(1)气体Ⅰ的主要成分为H2(填化学式,下同);滤渣Ⅱ的主要成分为Al(OH)3、Fe(OH)3.
(2)操作X为洗涤(填操作名称).
(3)向滤液Ⅰ中加入适量氨水,其目的是调节溶液的pH到5.4~7.5之间.
(4)在“酸浸”过程中,若在空气中“酸浸”时间过长,溶液中Fe2+含量将下降,其原因是(用离子方程式表示):4Fe2++O2+4H+═4Fe3++2H2O.
(5)为测定滤液Ⅰ中的Fe2+的含量,实验室中常用酸性高锰酸钾溶液进行滴定,该反应的离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;取20.00mL滤液Ⅰ于锥形瓶中,用0.1mol/L酸性高锰酸钾溶液滴定到终点时消耗了标准酸性高锰酸钾溶液12.00mL,则滤液Ⅰ中c(Fe2+)=0.3mol/L.
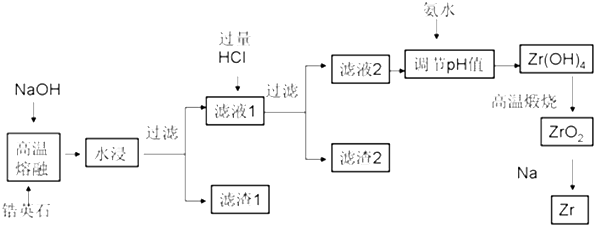
已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
ZrSiO4+4NaOH═Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3或H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发浓缩、冷却结晶、过滤,可回收得到铁的氯化物FeCl3晶体.
| A. | 转移容易后未洗涤烧杯和玻璃棒就直接定容 | |
| B. | 称氢氧化钠固体时直接放在称量纸上称 | |
| C. | 在容量瓶中进行定容时俯视刻度线 | |
| D. | 定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
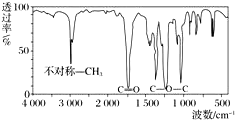 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )| A. | 其化学式为C4H8O2 | |
| B. | 其满足右侧图象的酯有3种 | |
| C. | 鉴定该有机物的结构可用红外光谱或核磁共振氢谱 | |
| D. | 若结构为CH3COOCH2CH3,其核磁共振氢谱中有3个峰 |
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池铜是负极 | |
| C. | 电子沿导线由锌流向铜,通过硫酸溶液被氢离子得到而放出氢气 | |
| D. | 铜锌原电池工作时,锌被硫酸溶解,所以才产生电子 |
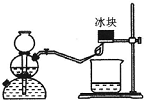 (1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.
(1)下面所列的是中学化学实验室中几种常见的仪器:容量瓶、酸式滴定管、碱式滴定管、温度计、量筒、托盘天平、普通漏斗、玻璃棒、烧杯.