题目内容
17.向25.8g含少量氯化钠杂质的碳酸钠白色固体中慢慢加入100g的稀盐酸,到恰好不再产生气体为止,共收集到8.8g干燥的二氧化碳气体.求(精确到0.1%).(1)白色固体中碳酸钠的质量分数是什么?
(2)所得溶液中氯化钠的质量分数是多少?
分析 (1)加入盐酸发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,根据质量定比关系计算碳酸钠的质量,进而计算样品中碳酸钠的质量分数;
(2)反应后溶液中氯化钠为样品中氯化钠与碳酸钠同盐酸反应得到的NaCl质量之和,溶液质量=样品质量+盐酸质量-二氧化碳质量,进而计算反应后溶液中氯化钠的质量分数.
解答 解:设样品中碳酸钠的质量为m,反应生成NaCl的质量为x,则:
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117 44
m x 8.8g
所以m=$\frac{8.8g×106}{44}$21.2g
x=$\frac{8.8g×117}{44}$=2.34g
(1)样品中碳酸钠的质量分数为$\frac{21.2g}{25.8g}$×100%=82.2%,
答:样品中碳酸钠的质量分数为82.2%;
(2)样品中NaCl的质量为25.8-21.2g=4.6g,则反应后溶液中NaCl的质量为4.6g+2.34g=6.94g,溶液质量为25.8g+100g-8.8g=117g,故溶液中NaCl的质量分数为$\frac{6.94g}{117g}$×100%=5.9%,
答:得溶液中氯化钠的质量分数是5.9%.
点评 本题考查混合物计算,涉及化学方程式计算、质量分数计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
7.超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO?2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下,用气体传感器测得不同时间的NO和CO浓度如下表:
请回答:(以下各题均不考虑温度变化对催化效率的影响):
(1)前2s内的平均反应速度v (N2)=1.875×10-4mol•L-1•s-1;
(2)在该温度下,反应的平衡常数K=5000,若升高温度时,K值变小,则该反应的△H<0 (填写“>”、“<”、“=”);
(3)若在容器中发生上述反应,达平衡后,下列措施能提高NO转化率的是CD
A.加入催化剂 B.升高温度 C.降低温度D.缩小容器体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组对比实验,部分实验条件已经填在下面实验设计表中,请在下面设计表的空格中填入剩余的实验条件数据.
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)前2s内的平均反应速度v (N2)=1.875×10-4mol•L-1•s-1;
(2)在该温度下,反应的平衡常数K=5000,若升高温度时,K值变小,则该反应的△H<0 (填写“>”、“<”、“=”);
(3)若在容器中发生上述反应,达平衡后,下列措施能提高NO转化率的是CD
A.加入催化剂 B.升高温度 C.降低温度D.缩小容器体积
(4)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率.为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组对比实验,部分实验条件已经填在下面实验设计表中,请在下面设计表的空格中填入剩余的实验条件数据.
| 实验编号 | T/℃ | NO初始浓度 ( mol•L-1) | CO初始浓度 ( mol•L-1) | 催化剂的比表面积 ( m2•g-1) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
5.向X的溶液中加入Y试剂,产生沉淀的量变化关系符合下图所示的情形的是( )
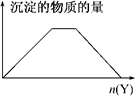

| A. | 向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| B. | 向HCl和AlCl3的混合溶液中滴加溶液 | |
| C. | 向KAl(SO4)2溶液中滴加NaOH溶液 | |
| D. | 向NH4Cl和MgCl2的混合溶液中滴加NaOH溶液 |
4.现有A、B、C、D、E五种钠盐,它们分别是NaClO、Na2SO3、NaCl、NaHCO3、NaHSO4中的某一种.为验证各种物质的具体成分,将固体药品分别配成溶液后进行实验:
(1)某同学进行了如下实验,请完成实验内容.
(2)写出B、C两溶液混合时反应的离子方程式ClO-+SO32-=Cl-+SO42-.
(1)某同学进行了如下实验,请完成实验内容.
| 序号 | 实验操作 | 实验结论 |
| 1 | 将D溶液分别加入其他溶液中时,B、E中有气体产生 | D的化学式为NaHSO4 |
| 2 | 将B溶液和C溶液混合时,无明显现象,再向混合溶液中加入D溶液,仍无明显现象. | C的化学式NaClO E的化学式KHCO3 |
 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题: 现.
现.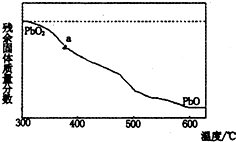 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3