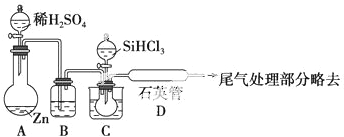
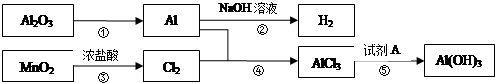
题目内容
12.如图所示,甲是刚浸过的NaCl溶液的石蕊试纸,A、B两铜片通过导线连接电源两极,在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则与A相连的是电源的正极,可发现滤纸的B极边沿附近有蓝色出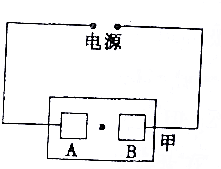 现.
现.
分析 根据图知,甲是电解池,电极材料是Cu,则阳极上Cu失电子发生氧化反应,阴极上氢离子放电生成氢气,同时阴极附近有NaOH生成,阴极附近溶液呈碱性,石蕊试液遇碱变红色;
MnO4-为紫色,且电解过程中MnO4-向阳极移动,据此判断A连接的电源名称及B极附近颜色变化.
解答 解:根据图知,甲是电解池,电极材料是Cu,则阳极上Cu失电子发生氧化反应,阴极上氢离子放电生成氢气,同时阴极附近有NaOH生成,阴极附近溶液呈碱性,石蕊试液遇碱变红色;
MnO4-为紫色,且电解过程中MnO4-向阳极移动,
在铜片间的滤纸上滴一滴KMnO4溶液,通电一段时间后,发现AB两极间的紫红色圆点向A极移动了一段距离,则A为阳极,与A相连的是电源正极;
B是阴极,B电极附近有NaOH生成,石蕊试液遇NaOH溶液呈蓝色,所以可发现滤纸的B极边沿附近有蓝色出现,故答案为:正;蓝.
点评 本题考查电解原理,为高频考点,明确离子放电顺序、电解质溶液中阴阳离子移动方向是解本题关键,注意:较活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.

练习册系列答案
相关题目
2.下列说法不正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 铁在潮湿的空气中容易腐蚀 | |
| C. | 镀锌的铁制品比镀锡的铁制品耐用 | |
| D. | 常温下铝跟稀硫酸快速反应,跟浓硫酸不反应 |
20.乙烯是农业上常用的一种催熟剂,能够促进果实的成熟,下列关于有关说不正确的是( )
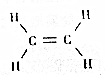
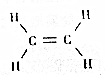
| A. | 乙烯是由碳、氢两种元素组成的 | |
| B. | 乙烯中碳元素的质量分数为85.7% | |
| C. | 乙烯是一种有机高分子化合物 | |
| D. | 乙烯中碳、氢两种元素的原子个数比是1:2 |
7.下列化学实验能达到目的是( )
| A. | 用饱和NaHCO3溶液除CO2中的氯化氢气体 | |
| B. | SO2与乙烯的混合气体依次通入酸性高锰酸钾溶液、浓硫酸洗气后可得到纯净的SO2 | |
| C. | 用酒精萃取碘水中的碘单质 | |
| D. | 用CaO干燥Cl2 |
3.在相同温度下(T=500K),有相同容积的甲、乙两容器,且保持容积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2.下列叙述中错误的是( )
| A. | 化学反应速率:乙>甲 | B. | 平衡时O2的浓度:乙>甲 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时SO2的体积分数:乙>甲 |