题目内容
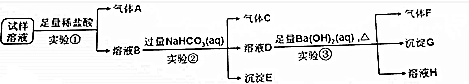
4.现有A、B、C、D、E五种钠盐,它们分别是NaClO、Na2SO3、NaCl、NaHCO3、NaHSO4中的某一种.为验证各种物质的具体成分,将固体药品分别配成溶液后进行实验:(1)某同学进行了如下实验,请完成实验内容.
| 序号 | 实验操作 | 实验结论 |
| 1 | 将D溶液分别加入其他溶液中时,B、E中有气体产生 | D的化学式为NaHSO4 |
| 2 | 将B溶液和C溶液混合时,无明显现象,再向混合溶液中加入D溶液,仍无明显现象. | C的化学式NaClO E的化学式KHCO3 |
分析 将D溶液分别加入其他溶液中时,B、E中有气体产生,D为强酸性物质NaHSO4,B溶液和C溶液混合时,无明显现象,再向该混合液中加入D溶液,仍无明显现象,次氯酸钠能将亚硫酸钠氧化生成硫酸钠,硫酸钠和硫酸氢钠不反应,所以无明显现象,则B是Na2SO3,E是NaHCO3,结合物质的性质分析解答.
解答 解:将D溶液分别加入其他溶液中时,B、E中有气体产生,D为强酸性物质NaHSO4,B溶液和C溶液混合时,无明显现象,再向该混合液中加入D溶液,仍无明显现象,次氯酸钠能将亚硫酸钠氧化生成硫酸钠,硫酸钠和硫酸氢钠不反应,所以无明显现象,则B是Na2SO3,C是NaClO,E是NaHCO3,结合物质的性质分析解答.
(1)通过以上分析知,C是NaClO,D是NaHSO4,B是Na2SO3,E是NaHCO3,
故答案为:NaHSO4;NaClO;NaHCO3;
(2)次氯酸根离子具有强强氧化性,亚硫酸根离子具有还原性,二者能发生氧化还原反应生成氯离子和硫酸根离子,离子反应方程式为:ClO-+SO32-=Cl-+SO42-,
故答案为:ClO-+SO32-=Cl-+SO42-.
点评 本题考查了无机物的推断,明确物质的性质是解本题关键,结合物质之间的反应来分析解答,注意亚硫酸盐能被次氯酸盐氧化生成硫酸盐,为易错点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.2007年10月24日18时05 分,就在这天与山、山与水的环拥之中,“嫦娥奔月”,一个流传了千年的神话,中国首颗探月卫星发射,在有着“月亮城”之称的高原航天城梦想成真.发射嫦娥一号卫星的长征三号甲运载火箭的第三级发动机使用的低温燃料为液氧和液氢.下列有关说法不正确的是( )
| A. | 液氧和液氢最好在临发射前的一段时间加注 | |
| B. | 氢气可由电解水获得 | |
| C. | 燃烧产物对发射环境没有污染 | |
| D. | 氢是一次能源,可以自己产生 |
16.甲乙丙是三种不含相同离子的可溶性电解质.他们所含的离子如右表所示.取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)<c(乙)<c(丙),下列说法正确的是( )
| 阳离子 | Na+NH4+Fe3+ |
| 阴离子 | OH- Cl- SO42- |
| A. | 甲中一定含有Na+ | B. | 乙中一定含有NH4+ | ||
| C. | 丙中一定含有 Fe3+ | D. | 丙中一定含有SO42- |
13.反应A+B?C在温度T1下进行,反应D+E?F在温度T2下进行,已知T2>T1,且D和E的浓度均大于A和B的浓度(其它条件均相同)则两者的反应速率( )
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法确定 |