题目内容
8. 砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:
砷化镓属于第三代半导体,其晶胞结构如如图所示.请回答下列问题:(1)下列说法中正确的是C.
A.电负性:As<Ga B.第一电离能:As<Ga
C.砷和镓都属于p区元素 D.砷和镓在不同周期
(2)砷化镓(GaAs)是将(CH3)3Ga和AsH3用MOCVD方法在700℃进行制备得到,其中(CH3)3Ga中镓原子的杂化方式为sp2.
(3)Ga的基态原子核外电子排布式为1s22s22p63s23p63d104s24p1.
(4)AsH3的沸点比NH3低,其原因是NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键.
分析 (1)A.同周期元素从左到右电负性逐渐增大;
B.同周期元素从左到右第一电离呈增大趋势,但第VA族大于第IIIA族,第IIA族大于第IIIA族;
C.根据砷和镓的价层电子特点判断;
D.依据原子序数判断;
(2)利用价层电子对互斥模型判断分子的空间构型和杂化方式;
(3)根据能量最低原理书写电子排布式;
(4)从是否形成氢键的角度分析,形成分子间氢键沸点高.
解答 解:A.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故A错误;
B.同周期元素从左到右第一电离呈增大趋势,但第VA族大于第IIIA族,第IIA族大于第IIIA族,所以则第一电离能:As>Ga,故B错误;
C.砷和镓的价层电子都为sp电子,位于周期表p区,故C正确;
D.砷和镓在相同的周期,均在第四周期,故D错误,故选C;
(2)AsH3中含有3个δ键和1个孤电子对,为三角锥形,(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,故答案为:sp2;
(3)Ga的原子序数为31,核外电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
(5)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
故答案为:NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键.
点评 本题考查了元素周期律的递变规律、分子空间构型以及杂化类型的判断、电子排布式以及氢键等知识,题目难度较大,注意相关基础的把握和方法的积累.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.镁/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是( )
| A. | 电池总反应的离子方程式为:Mg+H2O2+2H+═Mg2++2H2O | |
| B. | 负极的电极反应为:H2O2+2H++2e-═2H2O | |
| C. | 工作时,正极周围海水的pH减小 | |
| D. | 电池工作时,溶液中的H+向负极移动 |
13.2007年10月24日18时05 分,就在这天与山、山与水的环拥之中,“嫦娥奔月”,一个流传了千年的神话,中国首颗探月卫星发射,在有着“月亮城”之称的高原航天城梦想成真.发射嫦娥一号卫星的长征三号甲运载火箭的第三级发动机使用的低温燃料为液氧和液氢.下列有关说法不正确的是( )
| A. | 液氧和液氢最好在临发射前的一段时间加注 | |
| B. | 氢气可由电解水获得 | |
| C. | 燃烧产物对发射环境没有污染 | |
| D. | 氢是一次能源,可以自己产生 |
20.乙烯是农业上常用的一种催熟剂,能够促进果实的成熟,下列关于有关说不正确的是( )
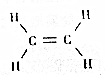
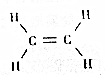
| A. | 乙烯是由碳、氢两种元素组成的 | |
| B. | 乙烯中碳元素的质量分数为85.7% | |
| C. | 乙烯是一种有机高分子化合物 | |
| D. | 乙烯中碳、氢两种元素的原子个数比是1:2 |
20.用洁净的玻璃棒蘸取新制的氯水,滴在蓝色石蕊试纸上现象( )
| A. | 蓝色石蕊试纸褪色 | B. | 蓝色石蕊试纸变红 | ||
| C. | 蓝色石蕊试纸先变红再褪色 | D. | 无现象 |