题目内容
11.将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(容器不参与反应),试判断下列情况溶液中存在的金属离子和金属单质.(1)若铁粉有剩余,则容器中不可能有Fe3+、Cu2+.
(2)若CuCl2有剩余,则容器中一定有Fe2+可能有Cu或Fe3+.
(3)若FeCl2和CuCl2都有剩余,则容器中不可能有Fe、Cu,一定有Fe2+.
分析 在金属活动性顺序中,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,向装有氯化铁溶液的烧杯中,加入一定量的Cu和Fe的混合粉末,则铁和铜都能与氯化铁溶液反应.氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,Fe有剩余,则Cu没有参加反应,溶液中不存在Fe3+、Cu2+,以此解答该题.
解答 解:氧化性:FeCl3>CuCl2>FeCl2,还原性Fe>Cu,
(1)反应后铁有剩余,发生Fe+2FeCl3=3FeCl2,Fe+CuCl2=Cu+FeCl2,Fe3+、Cu2+都不能存在,故答案为:Fe3+、Cu2+;
(2)若CuCl2有剩余,由于氯化铜可氧化单质铁,则不可能有Fe,容器中存在的情况有Fe3+、Fe2+或Cu、Fe2+,则一定有Fe2+,可能有Cu或Fe3+,故答案为:Fe2+;Cu或Fe3+;
(3)FeCl3和CuCl2都有剩余,则Fe、Cu均完全反应,不能存在,容器中一定存在Fe2+,故答案为:Fe、Cu;Fe2+.
点评 本题考查氧化还原反应以及铁的单质化合物的性质,题目难度不大,本题关键是把握物质的氧化性、还原性强弱判断反应的先后顺序.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
20.乙烯是农业上常用的一种催熟剂,能够促进果实的成熟,下列关于有关说不正确的是( )
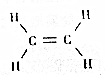
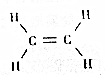
| A. | 乙烯是由碳、氢两种元素组成的 | |
| B. | 乙烯中碳元素的质量分数为85.7% | |
| C. | 乙烯是一种有机高分子化合物 | |
| D. | 乙烯中碳、氢两种元素的原子个数比是1:2 |
16.甲乙丙是三种不含相同离子的可溶性电解质.他们所含的离子如右表所示.取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)<c(乙)<c(丙),下列说法正确的是( )
| 阳离子 | Na+NH4+Fe3+ |
| 阴离子 | OH- Cl- SO42- |
| A. | 甲中一定含有Na+ | B. | 乙中一定含有NH4+ | ||
| C. | 丙中一定含有 Fe3+ | D. | 丙中一定含有SO42- |
3.在相同温度下(T=500K),有相同容积的甲、乙两容器,且保持容积不变,甲容器中充入1g SO2和1g O2,乙容器中充入2g SO2和2g O2.下列叙述中错误的是( )
| A. | 化学反应速率:乙>甲 | B. | 平衡时O2的浓度:乙>甲 | ||
| C. | 平衡时SO2的转化率:乙>甲 | D. | 平衡时SO2的体积分数:乙>甲 |
20.用洁净的玻璃棒蘸取新制的氯水,滴在蓝色石蕊试纸上现象( )
| A. | 蓝色石蕊试纸褪色 | B. | 蓝色石蕊试纸变红 | ||
| C. | 蓝色石蕊试纸先变红再褪色 | D. | 无现象 |
 .
.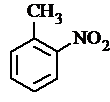 、
、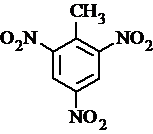 等
等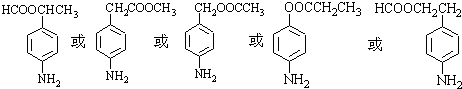 .
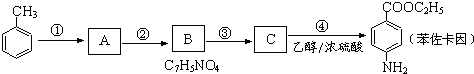
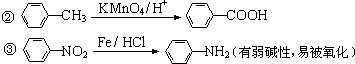
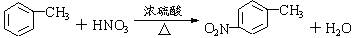
.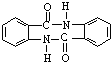 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下: