题目内容
19.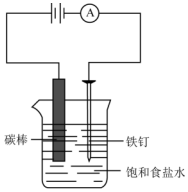 如图所示,回答下列问题:
如图所示,回答下列问题:(1)此装置的名称是电解池.
(2)氯化钠溶液中离子有Na+、Cl-、H+、OH-,其中,定向移动至阴极附近的离子有Na+和H+.
(3)阳极附近的产物是氯气,检验该物质的方法是用湿润的淀粉碘化钾试纸靠近导管口,若淀粉碘化钾试纸变蓝,则证明氯气存在.
(4)电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,工业上,利用电解饱和食盐水可制得多种产品,如有盐酸、漂白液等.(如举两例)
分析 如图所示,有电源,所以此装置的名称是电解池,与正极相连的碳棒为阳极,溶液中的氯离子失电子在阳极发生氧化反应生成氯气,铁钉为阴极,溶液中的氢离子得电子在阴极发生还原反应生成氢气,总的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,阳离子移向阴极,阴离子移向阳极,据此分析解答.
解答 解:(1)如图所示,有电源,所以此装置的名称是电解池,故答案为:电解池;
(2)氯化钠溶液中离子有Na+、Cl-、H+、OH-,其中,阳离子Na+和H+定向移动至阴极附近,故答案为:Na+、Cl-、H+、OH-;Na+和H+;
(3)溶液中的氯离子失电子在阳极发生氧化反应生成氯气,氯气具有强氧化性,能够氧化碘离子生成单质碘,碘遇到淀粉变蓝,所以检验氯气的方法是用湿润的淀粉碘化钾试纸靠近导管口,若淀粉碘化钾试纸变蓝,则证明氯气存在;
故答案为:氯气;用湿润的淀粉碘化钾试纸靠近导管口,若淀粉碘化钾试纸变蓝,则证明氯气存在;
(4)电解饱和食盐水得到氢氧化钠、氢气和氯气,化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,则工业上,可以利用电解饱和食盐水生成的氢气、氯气化合制盐酸,也可用氯气和氢氧化钠反应制漂白液等,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;盐酸、漂白液等.
点评 本题考查了饱和食盐水的电解原理应用,题目难度不大,注意把握阴阳极的反应原理是解题关键.

练习册系列答案
相关题目
8.CH3-CH=CH-Cl,该有机物能发生( )
①水解反应
②加成反应
③消去反应
④使溴水褪色
⑤光照条件下与氯气反应
⑥与硝酸银溶液产生白色沉淀
⑦聚合反应.
①水解反应
②加成反应
③消去反应
④使溴水褪色
⑤光照条件下与氯气反应
⑥与硝酸银溶液产生白色沉淀
⑦聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑤不能发生 | D. | 只有⑥不能发生 |
9.下列有关物质分类或归类正确的一组是( )
| A. | 漂白粉是化合物 | B. | 水玻璃是纯净物 | C. | 盐酸是电解质 | D. | 纯碱不属于碱 |
9.向10mL浓度均为3mol•L-1的HNO3与H2SO4的混合溶液中加入1.92g铜,充分反应后,设溶液体积仍为10mL,则产生的气体在标准状况下的体积是多少升( )
| A. | 0.448 L | B. | 0.224L | C. | 0.336L | D. | 无法求解 |

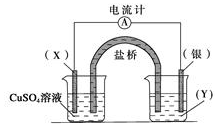 依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.