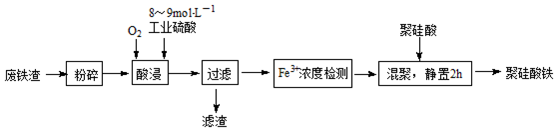
题目内容
8.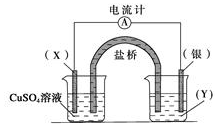 依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.
依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
(1)电极X的材料是Cu,电解质溶液Y是AgNO3;
(2)银电极为电池的正极,发生的电极反应为Ag++e=Ag;X电极上发生的电极反应为Cu-2e-=Cu2+.
(3)外电路中的电子是从X(Cu)电极流向Ag电极.
(4)硫酸铜溶液PH<7的原因是Cu2++2H2O?Cu(OH)2+2H+(用离子方程式解释)
分析 根据反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”分析,在反应中,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,则正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,电解质溶液为AgNO3 ,原电池中,电子从负极经外电路流向正极,由此分析解答.
解答 解:(1)由反应“2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,Ag+在正极上得电子被还原,电解质溶液为AgNO3 ,
故答案为:Cu;AgNO3;
(2)正极为活泼性较Cu弱的Ag,Ag+在正极上得电子被还原,电极反应为Ag++e=Ag,Cu被氧化,失电子,应为原电池的负极,电极反应为Cu-2e-=Cu2+,
故答案为:正;Ag++e=Ag;Cu-2e-=Cu2+;
(3)外电路中的电子是从负极铜电极流向正极银电极,故答案为:X(Cu);Ag;
(4)硫酸铜是强酸弱碱盐,溶液水解呈酸性,PH<7,其原因是Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+.
点评 本题考查原电池的设计及工作原理,注意电极反应式的书写方法,牢固掌握原电池中电极的判断,电极反应式的书写的方法性问题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.下列分散系中,明显与其他不同的一种是( )
| A. | 盐酸 | B. | 稀豆浆 | C. | NaOH溶液 | D. | FeCl3溶液 |
16.在标准状态下,二氧化碳气体的密度是( )
| A. | 1.964g/L | B. | 0.5091g/L | C. | 1.964g/mL | D. | 0.5091g/mL |
3.下列物质中,属于强电解质的是( )
| A. | 醋酸 | B. | Fe(OH)3 | C. | AgNO3 | D. | H2O |
20.下列叙述正确的是( )
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 用pH相等的盐酸、醋酸分别中和等体积等浓度的NaOH溶液,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸) | |
| D. | 室温下pH=3的醋酸溶液与pH=11的醋酸钠溶液中水电离出的C(H+)相等 |
17.下列各组离子在无色酸性溶液中可以大量共存的有( )
| A. | Ag+、K+、NO3-、Cl - | B. | K+、Cu2+、SO42-、HCO3- | ||
| C. | Mg2+、Cl-、SO42-、Na+ | D. | CO32-、K+、NO3-、Na+ |
18.下列化学用语表示正确的是( )
| A. | 甲烷的结构式:CH4 | |
| B. | 硫离子的结构示意图: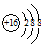 | |
| C. | Na2S的电子式: | |
| D. | 硫酸钠电离方程式:Na2SO4=Na2++SO42- |
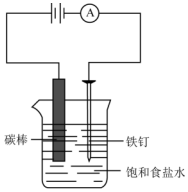 如图所示,回答下列问题:
如图所示,回答下列问题: