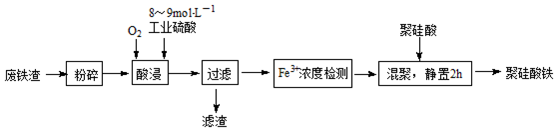
题目内容
4.0.5mol SO2共约含有1.5NA(或9.03×1023)个原子,它与40 gSO3所含硫原子数相等.分析 结合N=nNA、m=nM及分子构成计算.
解答 解:0.5mol SO2共约含有原子为0.5mol×3×NA=1.5NA(或9.03×1023 ),含0.5molS原子,则含硫原子数相等时SO3的质量为0.5mol×80g/mol=40g,
故答案为:1.5NA(或9.03×1023 );40.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量的关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.除去铁粉中混有的少量铝粉,可选用的试剂是( )
| A. | H2O | B. | 浓H2SO4 | C. | NaCl | D. | NaOH |
12.“一器多用”可实现多方面的化学实验探究,某课外活动小组学生利用图所示的仪器组合(省略夹持和净化装置)来完成下列实验,回答下列问题:
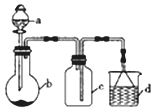
(1)仪器a的名称为分液漏斗,仪器a在使用前要查漏.
(2)该装置可用于某些气体的制取、收集及尾气处理裝置,表中3个实验的设计方案合理的是C(填序号)
(3)氨气和氯气接触时会产生白烟,请写出相应的化学方程式:8NH3+3Cl2=6NH4Cl+N2.
(4)上述装置若a中的物质为浓硫酸,b中的物质为Cu片,在加热条件下也可制取SO2.
①下列装置可用于SO2尾气处理的是(夹持仪器已略去)d(填序号).

用Fe2(SO4)3溶液也可吸收多余的SO2气体.写出SO2与Fe2(SO4)3溶液反应的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
②某小组用反应产生的CuSO4溶液来制取胆矾,测定所得胆矾(CuSO4•xH2O)中结晶水x的值,各次 称量的数据如表:
则胆矾应放在坩埚(填仪器名称)中加热;必须要进行恒重操作的原因是确保硫酸铜晶体完全失去结晶水;CuSO4•xH2O中的x=4.9(保留1位小数);若测定结果x偏大,可能的原因是a(填序号).
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却.

(1)仪器a的名称为分液漏斗,仪器a在使用前要查漏.
(2)该装置可用于某些气体的制取、收集及尾气处理裝置,表中3个实验的设计方案合理的是C(填序号)
| 选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
| A | 稀硝酸 | Cu | NO | H2O |
| B | 稀H2SO4 | CaCO3 | CO2 | NaOH溶液 |
| C | 浓氨水 | NaOH固体 | NH3 | H2O |
(4)上述装置若a中的物质为浓硫酸,b中的物质为Cu片,在加热条件下也可制取SO2.
①下列装置可用于SO2尾气处理的是(夹持仪器已略去)d(填序号).

用Fe2(SO4)3溶液也可吸收多余的SO2气体.写出SO2与Fe2(SO4)3溶液反应的离子方程式:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
②某小组用反应产生的CuSO4溶液来制取胆矾,测定所得胆矾(CuSO4•xH2O)中结晶水x的值,各次 称量的数据如表:
| 称量 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 质量(g) | m1=5.4 | m2=8.2 | m3=7.4 | m4=7.2 | m5=7.2 |
a.加热温度过高 b.胆矾晶体的颗粒较大 c.加热后放在空气中冷却.
9.用钠与水、铁与稀硫酸、铝与氢氧化钠溶液分别进行反应,若制取等物质的量的氢气,三种金属的物质的量之比是( )
| A. | 23:24:27 | B. | 1:2:3 | C. | 6:3:2 | D. | 6:2:3 |
16.在标准状态下,二氧化碳气体的密度是( )
| A. | 1.964g/L | B. | 0.5091g/L | C. | 1.964g/mL | D. | 0.5091g/mL |
14.下列液体均处于25℃,有关叙述正确的是( )
| A. | 某物质的溶液pH<7,则该物质一定是酸 | |
| B. | 等物质的量浓度的Na2CO3溶液的碱性强于NaHCO3溶液 | |
| C. | pH=4的番茄汁中c(H+)是pH=6的牛奶中c(H+)的2倍 | |
| D. | AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同 |
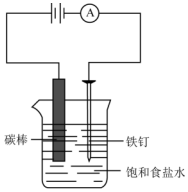 如图所示,回答下列问题:
如图所示,回答下列问题: