题目内容
11.3.84g Fe和Fe2O3的混合物溶于100mL某浓度的盐酸中,恰好使混合物溶解,生成0.03mol H2,向反应后的溶液中加入KSCN检验,溶液无明显现象,设HCl无挥发,反应后溶液的体积不变.(已知:氧化性Fe3+>H+,还原性Fe>Cl-)(1)求标准状况下生成氢气的体积?
(2)求反应后Cl-的物质的量浓度?
分析 (1)生成0.03mol H2,结合V=nVm计算;
(2)向反应后的溶液中加入KSCN检验,溶液无明显现象,则反应后溶液不含铁离子,发生Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑,结合反应及c=$\frac{n}{V}$计算.
解答 解:(1)生成0.03mol H2,V=0.3mol×22.4L/mol=0.672 L或672 mL,
答:标准状况下生成氢气的体积为0.672 L或672 mL;
(2)设Fe为x mol,Fe2O3为y mol,
由于反应后的溶液中加入KSCN检验,溶液无明显现象,则说明FeCl3完全反应,溶液中只生成FeCl2,
反应的方程式分别为Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑,
Fe2O3+6HCl=2FeCl3+3H2O
y 2y
2FeCl3+Fe=3FeCl2
2y y 3y
Fe+2HCl=FeCl2+H2↑
(x-y) (x-y) 0.03
则$\left\{\begin{array}{l}{x-y=0.03}\\{56x+160y=3.84}\end{array}\right.$
解得:x=0.04 mol、y=0.01 mol,
则FeCl2的总物质的量为3y+(x-y)=0.06 mol,
Cl-的浓度为$\frac{0.06mol×2}{0.1L}$=1.2 mol/L,
答:反应后Cl-的物质的量浓度为1.2mol/L.
点评 本题考查混合物的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意反应后不含铁离子及原子守恒应用,题目难度不大.

 应用题作业本系列答案
应用题作业本系列答案| 选项 | 强电解质 | 弱电解质 | 非电解质 |
| A | CaCO3 | H2SiO3 | 酒精 |
| B | NaCl | NH3 | BaSO4 |
| C | Fe | CH3COOH | 蔗糖 |
| D | HNO3 | Fe(OH)3 | H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 通过石油的裂解可以获得更多的汽油 | |
| B. | 蛋白质、纤维素、油脂、聚乙烯、淀粉都是高分子化合物 | |
| C. | 研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 | |
| D. | 石油、煤、天然气、植物油都属于化石燃料 |
| A. | 1.964g/L | B. | 0.5091g/L | C. | 1.964g/mL | D. | 0.5091g/mL |
| A. | 醋酸 | B. | Fe(OH)3 | C. | AgNO3 | D. | H2O |
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 用pH相等的盐酸、醋酸分别中和等体积等浓度的NaOH溶液,消耗两种酸的体积大小关系是:V(盐酸)>V(醋酸) | |
| D. | 室温下pH=3的醋酸溶液与pH=11的醋酸钠溶液中水电离出的C(H+)相等 |
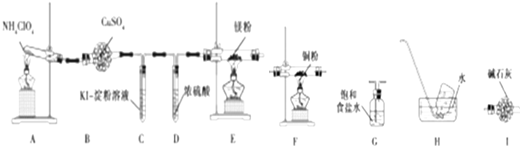
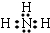 .
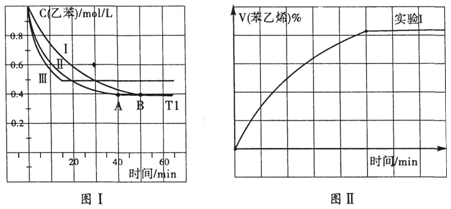
.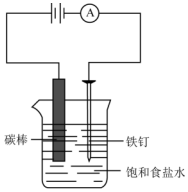 如图所示,回答下列问题:
如图所示,回答下列问题: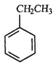 (g)+CO2(g)?
(g)+CO2(g)?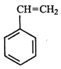 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行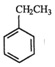 (g)?
(g)?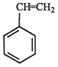 (g)+H2(g)△H1=-125KJ/mol
(g)+H2(g)△H1=-125KJ/mol .
.